摘要: 25℃时.0.1摩/升的氢氰酸(HCN)溶液.达到电离平衡时.电离度是0.01%. 下列有关说法中错误的是 ① 平衡时溶液的PH值等于4 ② 平衡时酸电离出的氢离子浓度约为水电离出氢离子浓度的1万倍 ③ 若升高温度.溶液的PH值变大 ④ 若用体积.浓度均相等的氢氧化钠溶液与之反应.所得溶液的PH值大于7 (A) ①.② (B) ①.③ ②.④
网址:http://m.1010jiajiao.com/timu3_id_34523[举报]
在甲、乙、丙三支试管中分别加入0.1摩/升Na2S2O3溶液2毫升、4毫升、6毫升,并在甲、乙两支试管中先分别加入蒸馏水至6毫升,然后再向三支试管各加入0.1摩/升硫酸溶液6毫升.
(1)哪一支试管最先出现浑浊?哪一支试管最迟出现浑浊?为什么?
(2)另取三支试管A、B、C分别加入0.1摩/升Na2S2O3溶液5毫升,将A试管浸入冷水中,将B试管浸入热水中,而C试管置于室温条件下,然后再分别向这三支试管中加入0.1摩/升H2SO4溶液5毫升.问:哪一支试管最先出现浑浊?哪一支试管最迟出现浑浊?为什么?
查看习题详情和答案>>NA代表阿佛加德罗常数,下列说法正确的是( )
A.常温常压下1摩水含有NA个H+和NA个OH—
B.28克一氧化碳气体所含电子数是20NA
C.0.1摩/升氯化钡溶液中Cl—数目是0.2NA
D.使56克Fe2+还原为单质,需结合2NA个电子
查看习题详情和答案>>
用实验证明 、
、 、
、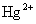 氧化能力的顺序,简述操作过程,产生的现象和化学方程式(仪器可自行选用).实验药品可在下列药品中选用:锌片、铜片、ZnCl2溶液(0.1摩/升)、CuSO4溶液(0.1摩/升)、Hg(NO3)2溶液(0.1摩/升).
氧化能力的顺序,简述操作过程,产生的现象和化学方程式(仪器可自行选用).实验药品可在下列药品中选用:锌片、铜片、ZnCl2溶液(0.1摩/升)、CuSO4溶液(0.1摩/升)、Hg(NO3)2溶液(0.1摩/升).
查看习题详情和答案>>