网址:http://m.1010jiajiao.com/timu3_id_344790[举报]
①准确称量3.920 g晶体溶于适量的稀硫酸中,配成100 mL浅绿色溶液X。
②取少量X于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色。
③取少量X于试管中加入浓NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。
④取出20.00 mLX于锥形瓶中,用0.020 mol·L-1KMnO4溶液滴定(不需要指示剂),当到达终点时,用去KMnO4溶液20.00 mL。
⑤再取20.00 mLX加入足量浓NaOH溶液,加热,生成的气体恰好被20 mL0.10 mol·L-1 H2SO4溶液完全吸收(生成正盐)。
⑥另取20.00 mLX向其中加入足量的BaCl2溶液,将沉淀过滤、洗涤、烘干、称量得1.00 g。
(提示:酸性KMnO4被还原成Mn2+,Mn2+在稀溶液中几乎呈无色)
试回答下列有关问题:
(1)A中所含的阳离子是_________;所含的阴离子为_________。
(2)把A溶于稀硫酸而不直接溶于水的主要原因是__________________
(3)第④操作中,对滴定管的使用主要有以下几步:
a.用特制洗涤液洗涤;b.用自来水冲洗后,用蒸馏水洗涤;c.再用_________润洗两次;d.装入标准液后,_________;e.调节标准溶液的液面在“0”或“0”刻度以下,固定在滴定架上。
(4)此实验的名称_________。
(5)此方案设计中有一步操作失误(此步操作在实验中无意义),它是第_________ (填编号),此步实验应如何设计?
(6)如果通过实验测得3.920 g晶体中含有的阴离子全部形成钡盐沉淀的质量为4.66 g,则A的化学式为_________。
查看习题详情和答案>>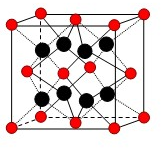 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
(1)T的基态原子的价电子排布式为
(2)U、V两种元素可组成多种结构的分子.请写出符合下列条件的物质的结构简式:
若化合物V8U8中V元素均采取sp3杂化方式
若化合物V8U8中V元素均采取sp2杂化方式
(3)写出一种与V22-互为等电子体的分子的化学式为
(4)甲和乙分别是W、X元素对应的氢化物,甲和乙中均属于10电子分子,甲极易溶于乙中,原因是
(5)ZY2晶体的晶胞如图所示,Z2+位于晶胞的顶点和面心,则Z2+的配位数为
①A元素原子最外层电子数是次外层电子数的2倍;
②B元素最高正价与最低负价的代数和为2;
③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;
④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出A元素在周期表中的位置_______________________。
(2)写出C的单质和强碱溶液反应的离子方程式________________________________。
(3)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。C4分子结构与白磷分子结构相似
 ,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由C4气态分子变成C2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由C4气态分子变成C2气态分子的热化学方程式:____________________________。(4)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6)B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:H2B-BH2+H2O
 _________________________。
_________________________。 ①A元素原子最外层电子数是次外层电子数的2倍;
②B元素最高正价与最低负价的代数和为2;
③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;
④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出A元素在周期表中的位置_______________________。
(2)写出C的单质和强碱溶液反应的离子方程式________________________________。
(3)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。C4分子结构与白磷分子结构相似
 ,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由C4气态分子变成C2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由C4气态分子变成C2气态分子的热化学方程式:____________________________。(4)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6)B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:H2B-BH2+H2O
 _________________________。
_________________________。 1.与该项成果相关的基础知识,不正确的是( )
A.有机聚合物通常相对分子质量很大,由共价键结合而成
B.在有机聚合物中掺入金属正离子即成为导电聚合物
C.导电聚合物比重小、强度大、可塑性好
D.导电聚合的金属、电解质、半导体的导电微粒不同
2.厦门特大走私案中查出赖昌星走私犯罪集团走私的物品主要包括成品矿物油、植物油、香烟、汽车、纺织原料、电子机械、钢材等,从化学角度分析其中不包括的物质类别是( )
A.酸类
B.酯类
C.纤维类
D.烃类
3.三位科学家研究了以聚乙炔为代表的导电聚合物,下列说法错误的是( )
A.聚乙炔是加聚反应的产物
B.具有单、双键交替长链的高分子有可能成为导电塑料
C.聚乙炔在空气中不稳定,且不易溶解
D.聚乙炔的结构简式是![]()
查看习题详情和答案>>