摘要:实验室制取下列气体的方法正确的是 [ ] (A)Cl2:将NaCl晶体.MnO2和浓H2SO4混合共热 (B)C2H2:将电石块和水在启普发生器中反应 (C)CH4:将醋酸钠晶体与碱石灰混合共热 (D)H2S:将硫化亚铁与稀HNO3反应
网址:http://m.1010jiajiao.com/timu3_id_34395[举报]
实验室中制取下列气体的方法正确的是()
- A.Cl2:NaCl晶体、MnO2、浓H2SO4共热
- B.C2H2:将电石块和水在启普发生器中反应
- C.CO2:将大理石和稀硫酸在烧瓶中共热
- D.NO:将Cu片与浓HNO3反应
实验室中制取下列气体的方法正确的是( )
A.Cl2:NaCl晶体、MnO2、浓H2SO4共热
B.C2H2:将电石块和水在启普发生器中反应
C.CO2:将大理石和稀硫酸在烧瓶中共热
D.NO:将Cu片与浓HNO3反应
查看习题详情和答案>>
实验室中制取下列气体的方法正确的是( )
A.Cl2:NaCl晶体、MnO2、浓H2SO4共热
B.C2H2:将电石块和水在启普发生器中反应
C.CO2:将大理石和稀硫酸在烧瓶中共热
D.NO:将Cu片与浓HNO3反应
查看习题详情和答案>>
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请回答下列问题:
(1)实验室制取氯气的反应原理为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
①该反应中被还原的元素是
②取一定量的浓盐酸使其与二氧化锰反应,产生的氯气在标准状况下的体积为33.6L,则被氧化的HCl的物质的量为
(2)某同学用下列装置制备并检验Cl2的性质.
下列说法正确的是

a.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
b.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
c.Ⅲ图中:生成蓝色的烟
(3)若氯气罐发生泄漏,当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
a.NaOH b.NaCl c. KOH d. Na2CO3
(4)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去.加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是
查看习题详情和答案>>
(1)实验室制取氯气的反应原理为:MnO2+4HCl(浓)
| ||
①该反应中被还原的元素是
Mn
Mn
,还原剂是HCl
HCl
.②取一定量的浓盐酸使其与二氧化锰反应,产生的氯气在标准状况下的体积为33.6L,则被氧化的HCl的物质的量为
3mol
3mol
,反应中转移电子数为3NA或1.806×1024
3NA或1.806×1024
.(2)某同学用下列装置制备并检验Cl2的性质.
下列说法正确的是
b
b

a.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
b.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
c.Ⅲ图中:生成蓝色的烟
(3)若氯气罐发生泄漏,当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
d
d
.a.NaOH b.NaCl c. KOH d. Na2CO3
(4)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去.加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是
SO2
SO2
.将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色.为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是BaCl2
BaCl2
(填化学式).经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是SO2+C12+2H2O=4H++SO42-+2Cl-
SO2+C12+2H2O=4H++SO42-+2Cl-
.组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是 。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]= 。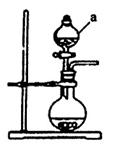
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。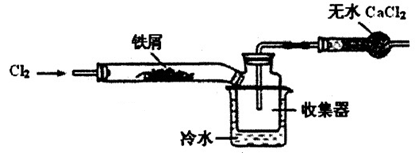
①下列操作步骤的正确排序为 (填字母)。
| A.体系冷却后,停止通入Cl2 |
| B.通入干燥的Cl2赶尽装置中的空气 |
| C.在铁屑下方加热至反应完成 |
| D.用干燥的H2赶尽Cl2 |
②该实验装置存在的明显缺陷是 。
(3)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
已知:NaCl+3H2O
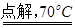 NaClO3+3H2
NaClO3+3H2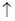 ,
,2NaClO3+4HCl=2C1O2
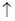 +Cl2
+Cl2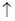 +2NaCl+2H2O。
+2NaCl+2H2O。有关物质性质:
| 物质 | 熔点/℃ | 沸点/℃ |
| C1O2 | -59 | 11 |
| Cl2 | -107 | -34.6 |
ClO2的生产流程示意图:
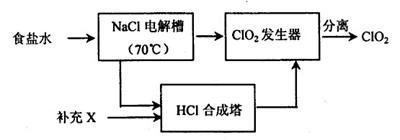
该工艺中,需要补充的物质X为 (填化学式),能参与循环的物质是 (填化学式)。从ClO2发生器中分离出ClO2可采用的方法是 。 查看习题详情和答案>>