摘要:(1)分液漏斗.烧瓶.酒精灯.导管 (2)+14H++6Cl- == 2Cr3++3Cl2↑+7H2O .浓H2SO4 .碘.使生成的碘升华并分离出来 (5)防止Cl2污染空气.
网址:http://m.1010jiajiao.com/timu3_id_343389[举报]
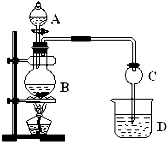 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:(1)写出圆底烧瓶内发生反应的化学方程式:
(2)球形干燥管C的作用是
(3)反应结束后D中的现象是
(4)检验乙醇中是否有水,可选用的试剂是
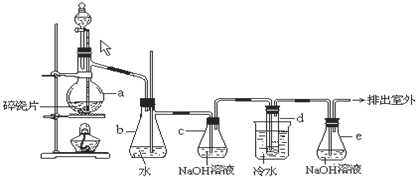
化学是一门以实验为基础的自然科学,掌握实验方法以及完成化学实验所必顺的技能是学好化学的关键.试回答下列实验问题:

(1)某同学认为MnO2与浓HCl反应制得的Cl2中含有HCl气体,该同学设计如图1所示装量时行验证.
已知B中试剂为CCl4,则:
①判定含有HCl气体的实验现象为:
②装置A中两仪器名称分别为:
③有人认为可将D装置溶液换成另一溶液,你认为可能为:
(2)某课外研究小组设计如图所示的实验过程,用石油化学工业的废气催化剂(主要成份为Ag/α-Al2O3)来回收金属银和α-Al2O3,部分操作过程省略.α-Al2O3作为催化剂的载体,且不溶于硝酸:
Ag/α-Al2O3
①Ag/α-Al2O3加HNO3溶解可选用图2所示装置中的
②实验操作II中,所需要的主要玻璃仪器有
③实验操作II中能否用自来水代替蒸馏水?
④操作I中所发生的离子反应方程式:
查看习题详情和答案>>

(1)某同学认为MnO2与浓HCl反应制得的Cl2中含有HCl气体,该同学设计如图1所示装量时行验证.
已知B中试剂为CCl4,则:
①判定含有HCl气体的实验现象为:
C装置中淀粉碘化钾试纸不变色,D装置中有白色沉淀生成.
C装置中淀粉碘化钾试纸不变色,D装置中有白色沉淀生成.
.②装置A中两仪器名称分别为:
分液漏斗
分液漏斗
、烧瓶
烧瓶
.③有人认为可将D装置溶液换成另一溶液,你认为可能为:
氢氧化钠溶液
氢氧化钠溶液
.(2)某课外研究小组设计如图所示的实验过程,用石油化学工业的废气催化剂(主要成份为Ag/α-Al2O3)来回收金属银和α-Al2O3,部分操作过程省略.α-Al2O3作为催化剂的载体,且不溶于硝酸:
Ag/α-Al2O3

①Ag/α-Al2O3加HNO3溶解可选用图2所示装置中的
a
a
(选填a、b、c)②实验操作II中,所需要的主要玻璃仪器有
漏斗、玻璃棒、烧杯
漏斗、玻璃棒、烧杯
.③实验操作II中能否用自来水代替蒸馏水?
否
否
(填“能”或“否”)原因是一般用自来水用氯气消毒,氯气和水反应生成盐酸和次氯酸Cl2+H2O=H++Cl-+HClO,盐酸和氧化铝反应生成氯化铝6 H++Al2O3=2Al3++3H2O,导致回收的氧化铝的质量减少,所以不能用自来水代替蒸馏水.
一般用自来水用氯气消毒,氯气和水反应生成盐酸和次氯酸Cl2+H2O=H++Cl-+HClO,盐酸和氧化铝反应生成氯化铝6 H++Al2O3=2Al3++3H2O,导致回收的氧化铝的质量减少,所以不能用自来水代替蒸馏水.
(结合有关离子方程式给以必要的文字说明)④操作I中所发生的离子反应方程式:
Ag+NO3-+2H+=3Ag++NO↑+H2O
Ag+NO3-+2H+=3Ag++NO↑+H2O
.氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).
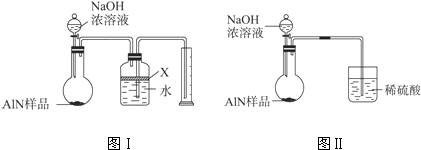
(1)实验有关操作为:a、往烧瓶中放入适量的AlN样品;b、从分液漏斗往烧瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为 .
(2)本试验中检查装置气密性的方法是 .
(3)广口瓶中的试剂X可选用 (填选项的标号).
A.浓氢氧化钠溶液 B.酒精 C.植物油 D.CCl4
(4)广口瓶中液体未装满,测得NH3的体积将 (填“偏大”、“偏小”或“无影响”).
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是 .
(6)若样品的质量为w g,氨气的体积为a L(标准状况),AlN的质量分数为 .
查看习题详情和答案>>

(1)实验有关操作为:a、往烧瓶中放入适量的AlN样品;b、从分液漏斗往烧瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为
(2)本试验中检查装置气密性的方法是
(3)广口瓶中的试剂X可选用
A.浓氢氧化钠溶液 B.酒精 C.植物油 D.CCl4
(4)广口瓶中液体未装满,测得NH3的体积将
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
(6)若样品的质量为w g,氨气的体积为a L(标准状况),AlN的质量分数为
 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g?cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用如图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g?cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用如图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式.
(2)瓶b的两个作用是
(3)容器c中NaOH溶液的作用是:
(4)瓶e的作用是
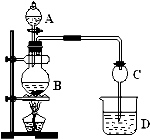 某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:(1)写出圆底烧瓶内发生反应的化学方程式为:
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
| 浓硫酸 |
| 加热 |
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| 加热 |
(2)反应中加入浓硫酸的作用是
催化剂、吸水剂
催化剂、吸水剂
.(3)球形干燥管C的作用是
防止倒吸;充分冷凝乙酸乙酯蒸气
防止倒吸;充分冷凝乙酸乙酯蒸气
.(4)反应结束后D中的现象是:
有细小的气泡冒出,溶液分层,无色油状液体在上层
有细小的气泡冒出,溶液分层,无色油状液体在上层
(5)分离出D中的乙酸乙酯时需要的玻璃仪器是
分液漏斗
分液漏斗
.