摘要:过二硫酸钾(K2S2O8)在高于100℃的条件下发生下列反应: 现称取一定的K2S2O8 固体.进行如下实验,加热使过二硫酸钾完全分解.通过测定氧气的体积计算过二硫酸钾的纯度.并且收集三氧化硫.进行观察和检验. (1)试从下图中选用几种必要的装置.连接成一整套实验装置.这些选用装置的接口编号连接顺序是 . (2)观察到的三氧化硫的颜色和状态是 .将三氧化硫与水反应.鉴定反应产物中阴离子的方法是 . (3)若实验时称取过二硫酸钾的质量为w克.测得氧气的体积为a毫升.则此过二硫酸钾的纯度为 .
网址:http://m.1010jiajiao.com/timu3_id_343373[举报]
过二硫酸钾(K2S2O8)在高于100 ℃ 的条件下分解,发生反应的化学方程式为2K2S2O8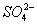 2K2SO4+2SO3↑+O2↑,现称取一定量的K2S2O8固体(含有不分解的杂质),进行如下实验:加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的纯度,并且收集三氧化硫,进行观察和检验。
2K2SO4+2SO3↑+O2↑,现称取一定量的K2S2O8固体(含有不分解的杂质),进行如下实验:加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的纯度,并且收集三氧化硫,进行观察和检验。
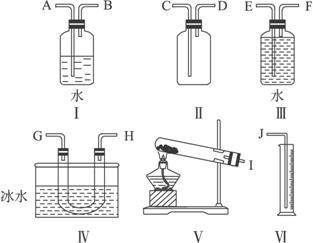
完成下列问题:
(1)试从图中选取几种必要的装置,连接成一整套实验装置,这些被选用装置的接口编号连接顺序为______________________________________________。
(2)观察到的三氧化硫的颜色和状态是___________,将三氧化硫与水反应,鉴定反应产物中阴离子的方法是___________________________。
(3)若实验时称取过二硫酸钾的质量为W g,测得氧气的体积(折算成标准状况)为a mL,则此过二硫酸钾的纯度为_________________。
查看习题详情和答案>>