网址:http://m.1010jiajiao.com/timu3_id_343208[举报]
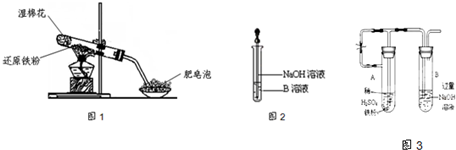
已知:①FeO+2H+=Fe2++H2O②Fe2O3+6H+=2Fe3++3H2O ③Fe3O4+8H+=Fe2++2Fe3++4H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为
| ||
| ||
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有FeE.只有Fe3O4
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用图3所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应.获得不含O2的蒸馏水的方法是
一段时间后,关闭止水夹,在试管
请根据上面的溶度积解答下列问题:
(1)把海水滤去悬浮杂质后,向海水中加入某种化学试剂,将Mg2+转化为沉淀.该化学试剂是利用了海边的贝壳(主要成分为CaCO3)制成,________(填“能”或“不能”)直接把贝壳研磨成粉末,撒入海水中使Mg2+转化为沉淀,其原因是________.
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,这种做法的理由是________,请你推测应把贝壳做怎样的加工处理________.
(3)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为________(填“可以”或“不可以”).在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他________(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是________.
(4)氢氧化镁不是海水提镁的最终物质,最终制备的是金属镁,所以需要将氢氧化镁转化为镁的某种化合物,然后将其加热熔融后电解,下面是几种镁的化合物的熔点:

过滤出
Mg(OH)2沉淀后,用什么试剂________(填化学式)将其溶解,你选择该试剂的理由是________.(5)将得到的氯化镁溶液在浓缩池中制得MgCl2·6H2O.然后将MgCl2·6H2O转移到干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,其原因是________.
实验室制KClO3,可利用下图装置。实验中的化学原理是利用MnO2和浓盐酸制得氯气,然后使氯气与热的KOH溶液(约70℃)反应制KClO3,其化学方程式为:3Cl2+6KOH![]()
5KCl+KClO3+3H2O。

请回答下列问题:
(1)B中的液体是________,其作用是________________________________________;
(2)已知C杯中装的是水,D管内装的是15mL30%KOH溶液,这种水浴加热方法的优点是________________,通过什么现象可以观察到KOH基本反应完毕___________________
__________________。
(3)E处管口塞着一团棉纱(已用Na2S2O3溶液浸湿),作用是利用其还原性吸收多余的Cl2,反应的离子方程式为________________________。
(4)已知KCl和KClO3在水中的溶解度如下表:
温度/℃ 0 20 40 60 80 100
KCl/℃ 27.6 34 40 45 51.1 56.7
KclO3/g 3.3 7 14 24.5 38.5 57
待D管内KOH基本反应完时,取所得混合溶液直接加热浓缩,则首先从溶液中析出的晶体是________________,当蒸发适量水后,趁热过滤,然后将滤液冷却,这时析出的晶体主要是________________________,欲进一步提纯KClO3,应采用的方法是________________
____________________。
查看习题详情和答案>>
根据物质性质的差异,我们可以考虑用两种方法进行物质的分离:物理方法和化学方法.物理方法是根据物质物理性质的不同而采用的分离方法.如过滤、结晶、蒸馏、萃取等.化学方法是利用物质间化学性质的差异,选用合适的试剂进行化学反应,然后再用物理方法将其分离.化学试剂的选择原则一般遵循:①
________;②________;③________.反应结束后应将被提纯的物质恢复原状.5KCl+KClO3+3H2O。

请回答下列问题:
(1)B中的液体是________,其作用是________________________________________;
(2)已知C杯中装的是水,D管内装的是15mL30%KOH溶液,这种水浴加热方法的优点是________________,通过什么现象可以观察到KOH基本反应完毕___________________
__________________。
(3)E处管口塞着一团棉纱(已用Na2S2O3溶液浸湿),作用是利用其还原性吸收多余的Cl2,反应的离子方程式为________________________。
(4)已知KCl和KClO3在水中的溶解度如下表:
温度/℃ 0 20 40 60 80 100
KCl/℃ 27.6 34 40 45 51.1 56.7
KclO3/g 3.3 7 14 24.5 38.5 57
待D管内KOH基本反应完时,取所得混合溶液直接加热浓缩,则首先从溶液中析出的晶体是________________,当蒸发适量水后,趁热过滤,然后将滤液冷却,这时析出的晶体主要是________________________,欲进一步提纯KClO3,应采用的方法是________________
____________________。
查看习题详情和答案>>