摘要:已知铅蓄电池总的化学方程式未:Pb+ PbO2+2H2SO4 2PbSO4+2H2O,镍镉碱性电池在放电时,其正极反应为:2NiO(OH)+2e-+2H2O=2Ni(OH)2 +2OH-,负极反应为:Cd+2OH--2e-= Cd(OH)2.铅蓄电池使用一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用. 镍镉碱性电池使用到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题: ⑴铅蓄电池放电时的负极反应为 ,其充电时阳极反应为 ⑵镍镉碱性电池在充电时的总反应方程式为 ⑶上述两种电池使用一段时间后,一个内阻变化不大,而另一个明显增大的主要原因可能是 ⑷如果铅蓄电池电池放电时回路中有2mol电子转移,消耗硫酸 mol
网址:http://m.1010jiajiao.com/timu3_id_342922[举报]
已知铅蓄电池总的化学方程式为Pb+PbO2+2H2SO4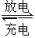 2H2O+2PbSO4,镍镉碱性充电电池在放电时,其正极反应为2NiO(OH)+2e-+2H2O===2Ni(OH)2+2OH-,负极反应为Cd+2OH--2e-===Cd(OH)2.铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,电压明显下降,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
2H2O+2PbSO4,镍镉碱性充电电池在放电时,其正极反应为2NiO(OH)+2e-+2H2O===2Ni(OH)2+2OH-,负极反应为Cd+2OH--2e-===Cd(OH)2.铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,电压明显下降,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
(1)铅蓄电池在放电时的负极反应为_________.
其在充电时的阳极反应为_________.
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为_________.
(3)上述两种电池使用一段时间后,一个内阻明显增大,另一个内阻却几乎不变的主要原因可能是_________.
查看习题详情和答案>>
按要求回答下列问题
(1)用离子方程式解释纯碱溶液去除油污的原因:
(2)写出泡沫灭火器中反应的离子方程式[内液:Al2(SO4)3,外液:NaHCO3]:
(3)SOCl2是一种液态化合物,沸点为77℃.向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾生成,并有无色有刺激性气味气体逸出,该气体中含有使品红溶液褪色的SO2,根据实验现象,写出SOCl2与水反应的化学方程式:
蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3?6H20混合并加热,可得到无水AlCl3,解释原因:
(4)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为
②铅蓄电池在充电时阳极反应为
③如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4
(5)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):
c(OH-)-c(HA)=
查看习题详情和答案>>
(1)用离子方程式解释纯碱溶液去除油污的原因:
CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-
CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-
(2)写出泡沫灭火器中反应的离子方程式[内液:Al2(SO4)3,外液:NaHCO3]:
3HCO3-+Al3+=Al(OH)3↓+3CO2↑
3HCO3-+Al3+=Al(OH)3↓+3CO2↑
(3)SOCl2是一种液态化合物,沸点为77℃.向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾生成,并有无色有刺激性气味气体逸出,该气体中含有使品红溶液褪色的SO2,根据实验现象,写出SOCl2与水反应的化学方程式:
SOCl2+H2O=2HCl↑+SO2↑
SOCl2+H2O=2HCl↑+SO2↑
删去此空
删去此空
蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3?6H20混合并加热,可得到无水AlCl3,解释原因:
反应产生的氯化氢气体会抑制铝离子的水解
反应产生的氯化氢气体会抑制铝离子的水解
(4)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
| 放电 | 充电 |
①铅蓄电池在放电时负极反应为
Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
,②铅蓄电池在充电时阳极反应为
PbSO4+2H2O-2e-=4H++SO42-+PbO2
PbSO4+2H2O-2e-=4H++SO42-+PbO2
;③如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4
2
2
mol.(5)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):
c(OH-)-c(HA)=
10-8
10-8
mol/L.(2012?琼海一模)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
2H2O+2PbSO4;
镍镉碱性充电电池在放电时,其:
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
(1)铅蓄电池在放电时的负极反应为
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为
(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是
(4)如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4
查看习题详情和答案>>
| 放电 | 充电 |
镍镉碱性充电电池在放电时,其:
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
(1)铅蓄电池在放电时的负极反应为
Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
,其在充电时阳极反应为PbSO4+2H2O-2e-=PbO2+SO42-+4H+
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
;(2)镍镉碱性充电电池在充电时的总反应的化学方程式为
Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O
;(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是
铅蓄电池放电时离子浓度减小,而镍镉电池放电时离子浓度不变
铅蓄电池放电时离子浓度减小,而镍镉电池放电时离子浓度不变
;(4)如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4
2
2
mol.已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
2PbSO4+2H2O;镍镉碱性充电电池在放电时,其
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
(1)铅蓄电池在放电时的负极反应为
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为
(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是
查看习题详情和答案>>
| 放电 | 充电 |
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
(1)铅蓄电池在放电时的负极反应为
Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
,其在充电时阳极反应为PbSO4+2H2O-2e-=PbO2+SO42-+4H+
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
;(2)镍镉碱性充电电池在充电时的总反应的化学方程式为
Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O
;(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是
铅蓄电池放电时离子浓度减小,而镍镉电池放电时离子浓度不变
铅蓄电池放电时离子浓度减小,而镍镉电池放电时离子浓度不变
.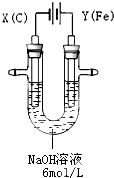 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.Ⅰ.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(1)电解过程中,X极是
阴
阴
极,电极反应是2H++2e-=H2↑
2H++2e-=H2↑
.(2)电解过程中,Y极放电的有
Fe和OH-
Fe和OH-
.(3)生成高铁酸根(FeO42-)的电极反应是
Fe+8OH--6e-=FeO42-+4H2O
Fe+8OH--6e-=FeO42-+4H2O
.Ⅱ.若用不同种电池作为上述实验的电源,请分析电池反应.
(1)铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
| 充电 | 放电 |
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
.(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH--2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
.(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料.已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N2H4完全燃烧的热化学方程式是
N2H4(1)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol
N2H4(1)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol
;肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是N2H4+4OH--4e-=4H2O+N2↑
N2H4+4OH--4e-=4H2O+N2↑
.(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.
写出该电池正极的电极反应:
O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
.(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是
10:10:5:1
10:10:5:1
.