摘要:24.燃煤锅炉的烟囱冒出的浓烟中含有SO2气体.污染空气.消除污染的方法一般是将浓烟通入( ) A.盐酸 B.碱溶液 C.盐溶液 D.水
网址:http://m.1010jiajiao.com/timu3_id_342296[举报]
(2009?长春一模)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率.已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2.
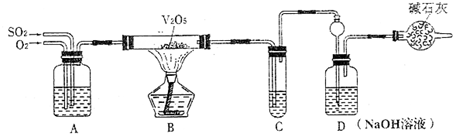
请回答下列问题:
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
(2)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是
(4)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg.若装置D增加的质量为a g,则此条件下二氧化硫的转化率是
×100%
×100%(用含字母的代数表示,结果可不化简).
查看习题详情和答案>>

请回答下列问题:
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
SO2(g)+
O2(g)?SO3(g);△H=-98.3kJ?mol-1
| 1 |
| 2 |
SO2(g)+
O2(g)?SO3(g);△H=-98.3kJ?mol-1
.| 1 |
| 2 |
(2)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是
提高二氧化硫的转化率
提高二氧化硫的转化率
;装置C中浓硫酸的作用为吸收SO3
吸收SO3
.(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是
继续通入氧气一段时间
继续通入氧气一段时间
.(4)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg.若装置D增加的质量为a g,则此条件下二氧化硫的转化率是
| ||||
|
| ||||
|
(2008?驻马店二模)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,同时制取少量三氧化硫晶体,并测量反应后混合气体中SO2的含量,设计了如图所示的装置.

已知:V2O5在450℃左右,活性最好,温度过高或过低都会使催化剂活性下降.
(1)已知3.2g二氧化硫被氧气完全氧化成三氧化硫时,可以放出4.915kJ热量.则该反应的热化学方程式为
(2)A装置可用来观察SO2和氧气的进气量.实验时使A中氧气导管冒出的气泡与SO2导管冒出的气泡速率相近,其目的是
(3)检查完装置的气密性且加入药品后,开始进行实验.此时首先应该进行的操作是
(4)在实验过程中不能持续加热的理由是
(5)冰盐水的作用是
(6)能用于测定反应后混合气体中SO2含量的是
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液.
查看习题详情和答案>>

已知:V2O5在450℃左右,活性最好,温度过高或过低都会使催化剂活性下降.
(1)已知3.2g二氧化硫被氧气完全氧化成三氧化硫时,可以放出4.915kJ热量.则该反应的热化学方程式为
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ/mol
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ/mol
.(2)A装置可用来观察SO2和氧气的进气量.实验时使A中氧气导管冒出的气泡与SO2导管冒出的气泡速率相近,其目的是
使用过量氧气以提高SO2的转化率
使用过量氧气以提高SO2的转化率
.(3)检查完装置的气密性且加入药品后,开始进行实验.此时首先应该进行的操作是
加热(或点燃酒精灯)
加热(或点燃酒精灯)
.(4)在实验过程中不能持续加热的理由是
该反应为放热反应,温度过高催化剂活性降低
该反应为放热反应,温度过高催化剂活性降低
.(5)冰盐水的作用是
降温,冷却SO3使之成为晶体
降温,冷却SO3使之成为晶体
.(6)能用于测定反应后混合气体中SO2含量的是
BC
BC
(填字母)A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液.
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)元素的非金属性为(原子的得电子能力):Q
弱于
弱于
W(填“强于”或“弱于”).可证明此结论的实验事实是在Na2CO3溶液中加入稀硫酸,会有大量的气泡冒出
在Na2CO3溶液中加入稀硫酸,会有大量的气泡冒出
.(2)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;若增大化学反应速率,可向溶液中加催化剂
| ||
MnO2
MnO2
或FeCl3
FeCl3
.(3)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ.又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H=
(3a-4b)KJ/mol
(3a-4b)KJ/mol
(注:题中所设单质均为最稳定单质)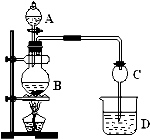 某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:(1)写出圆底烧瓶内发生反应的化学方程式为:
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
| 浓硫酸 |
| 加热 |
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| 加热 |
(2)反应中加入浓硫酸的作用是
催化剂、吸水剂
催化剂、吸水剂
.(3)球形干燥管C的作用是
防止倒吸;充分冷凝乙酸乙酯蒸气
防止倒吸;充分冷凝乙酸乙酯蒸气
.(4)反应结束后D中的现象是:
有细小的气泡冒出,溶液分层,无色油状液体在上层
有细小的气泡冒出,溶液分层,无色油状液体在上层
(5)分离出D中的乙酸乙酯时需要的玻璃仪器是
分液漏斗
分液漏斗
.实验室分析白铁(镀锌)样品成分,称取1.00g样品放在烧杯中加入过量的盐酸,然后用玻片盖住烧杯,首先观察到有大量的气泡冒出,后来放出气体速度变慢,最后完全反应.接着加入过量的氢氧化钠溶液,(氢氧化锌溶于氢氧化钠溶液)过滤,分离出灰绿色沉淀;该沉淀在空气中加热至质量不变;最后得1.20g红色粉末.已知锌及其化合物与铝及其化合物性质相似,试回答:
(1)白铁镀锌的作用是
(2)放出气体的速度由快到慢的原因是
(3)锌在样品中的质量分数是
查看习题详情和答案>>
(1)白铁镀锌的作用是
在铁表面增加保护层,防止铁被空气氧化
在铁表面增加保护层,防止铁被空气氧化
.(2)放出气体的速度由快到慢的原因是
锌先被溶解,铁再发生反应,随着反应的进行,HCl浓度降低,导致反应速率由快到慢
锌先被溶解,铁再发生反应,随着反应的进行,HCl浓度降低,导致反应速率由快到慢
.(3)锌在样品中的质量分数是
16%
16%
.