摘要:16.已知2H2S+SO2=3S↓+2H2O.向一定量的Na2S与Na2S2O3固体混合物中加入适量的稀H2SO4.恰好完全反应.得到amol的沉淀和bmol的气体.下列有关物质的量的分析中错误的是 (A)还原剂的物质的量可能为a/2mol.氧化剂的物质的量可能为mol (B)硫化钠的物质的量可能为mol (C)硫代硫酸钠的物质的量可能为mol (D)消耗的硫酸的物质的量可能为mol
网址:http://m.1010jiajiao.com/timu3_id_342087[举报]
已知①2H2S + SO2 == 3S↓+ 2H2O ② S + 2H2SO4(浓)== 3SO2↑+ 2H2O ③ 3S + 6KOH == 2K2S + K2SO3 + 3H2O 则下列说法正确的是
[ ]
A.反应①说明能与酸反应,具有碱性氧化物的通性
B.反应②改用稀硫酸,则放出H2
C.反应②和③说明硫具有两性元素的性质
D.上述反应说明硫既有氧化性又有还原性
查看习题详情和答案>>
B.反应②改用稀硫酸,则放出H2
C.反应②和③说明硫具有两性元素的性质
D.上述反应说明硫既有氧化性又有还原性
(1)下列反应中属于氧化还原反应的是
A.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O; B.SO2+2H2S=2H2O+3S↓;
C.Ba(OH)2+H2SO4=BaSO4↓+2H2O; D.Cl2+2NaOH=NaCl+NaClO+H2O.
(2)已知KMnO4 与浓盐酸发生如下反应:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.在上述反应中,氧化剂是
 .
.
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子.请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
②反应中1mol氧化剂得到
查看习题详情和答案>>
ABD
ABD
.A.MnO2+4HCl(浓)
| ||
C.Ba(OH)2+H2SO4=BaSO4↓+2H2O; D.Cl2+2NaOH=NaCl+NaClO+H2O.
(2)已知KMnO4 与浓盐酸发生如下反应:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.在上述反应中,氧化剂是
KMnO4
KMnO4
,氧化产物是Cl2
Cl2
.用单线桥法标出此反应的电子转移方向和数目

(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子.请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
K2SO3
K2SO3
+KIO3
KIO3
+H2SO4
H2SO4
→I2
I2
+K2SO4
K2SO4
+H2O
H2O
②反应中1mol氧化剂得到
5
5
mol电子.已知:A是一种无色黏稠液体,它的水溶液可作消毒杀菌剂,B是一种过渡金属,C、D为同主族元素的单质,E、I在常温常压下为气态化合物.它们有如下转化关系(某些反应条件及生成物已略去).
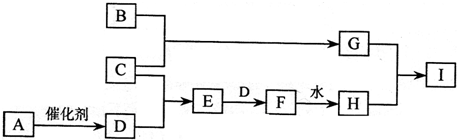
(1)在工业上可以用B所制容器贮存H的浓溶液,由此表现了H的
(2)写出用G与H的稀溶液制取I的离子方程式:
(3)若将E和I同时通入一集气瓶中,过一段时间可观察到的现象是
(4)A与E也可发生反应,写出其化学反应方程式
(5)在A→D的反应中,若生成了24g D,则转移的电子数是
查看习题详情和答案>>

(1)在工业上可以用B所制容器贮存H的浓溶液,由此表现了H的
强氧化
强氧化
性.(2)写出用G与H的稀溶液制取I的离子方程式:
FeS+2H+═Fe2++H2S↑
FeS+2H+═Fe2++H2S↑
(3)若将E和I同时通入一集气瓶中,过一段时间可观察到的现象是
瓶壁出现黄色固体和小液滴
瓶壁出现黄色固体和小液滴
,发生反应的化学方程式为2H2S+SO2═3S+2H2O
2H2S+SO2═3S+2H2O
,其中氧化产物与还原产物的质量比为2:1
2:1
.(4)A与E也可发生反应,写出其化学反应方程式
H2O2+SO2═H2SO4
H2O2+SO2═H2SO4
(5)在A→D的反应中,若生成了24g D,则转移的电子数是
9.03x1023
9.03x1023
个.