网址:http://m.1010jiajiao.com/timu3_id_341929[举报]
(1)A处应选用图2装置中的(填写编号)
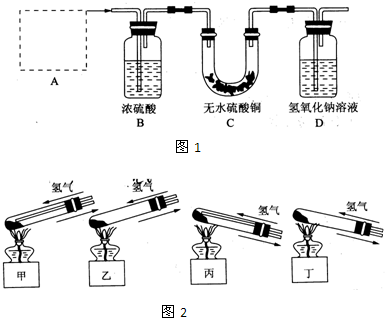
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和
(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是
Ⅱ、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言
①A、B、D位于同一周期,D、Y位于同一主族.A的原子的最外层电子数是其次外层电子数的2倍.
②D的氢化物是最常用的溶剂,E的单质是一种生活中常见的金属.
请回答:
(1)AD2中具有的化学键的类型是
(2)高温时,6g A的单质与D的气态氢化物反应,生成两种还原性气体,吸收的热量为65.75kJ,其反应的热化学方程式是
(3)D与氢元素可组成含有10个电子的X-,与X-组成元素相同,原子数个数比也相同的分子的电子式是


(4)将盛有一定量红棕色气体BD2的4L容器压缩至2L,待气体颜色不再变化时,容器内的压强(填“大于”、“等于”或“小于”)
(5)E的某种化合物可用作净水时的混凝剂,其原理是(用离子方程式表示)
(6)YD2气体通入足量BaCl2和B的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是
请回答下列问题。
(1)Z的原子结构示意图为___________;化合物BA4的电子式为___________。
(2)化合物Y2X2中含有的化学键类型有___________(填序号)。
A.离子键 B.极性共价键
C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是_____________________(填化学式),其主要原因是_____________________________。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为________________________。
(5)常温常压下,由A、B、X可组成的液态物质甲。现有2.
A、B、C是原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2。请回答:
(1)D元素较稳定的化合价是 。
(2)C与A形成的最简单分子是 分子(填:“极性”或“非极性”),该分子再与A+元素结合成离子时,ACA键的键角发生改变,其原因是
(3)在烃中,若要求所有的原子都有可能在同一个平面中,则对碳原子成键轨道的要求是:
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原子。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是
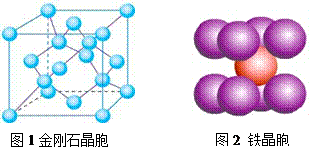 (5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。
A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)
请填写下列空白:
(1)B的电子式为 ;
(2)D固体可用于净水,请用相应的离子方程式及简单文字说明原因:
;
(3)反应⑥的化学方程式为 ;
反应④在冶金工业上属于 (填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为 ;
(5)反应②的化学方程式为 ;
反应③的离子方程式为 ;
(6)收集一试管H,将其倒置于水槽中,然后向试管中通入一定量的O2使试管内液面上升,最终剩余气体占试管容积的一半,则原有H与所通入O2的体积比为 。
查看习题详情和答案>>