网址:http://m.1010jiajiao.com/timu3_id_341471[举报]
海水中主要离子的含量如下:
|
成分 |
含量/(mg/L) |
成分 |
含量/(mg/L) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Mg2+ |
1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
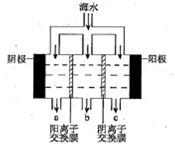
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。

(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
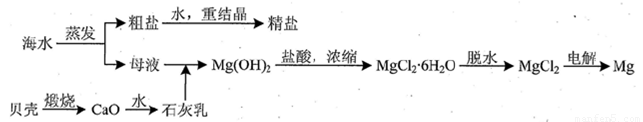
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2•6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。
查看习题详情和答案>>
海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
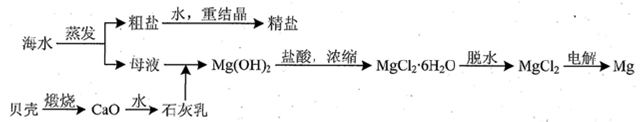
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。 查看习题详情和答案>>
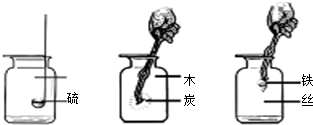
(1)写出上述三个反应化学方程式
①______;
②______;
③______.
(2)比较上述三个反应,发现它们有许多共同点:请你写出其中两点:
①______;②______.
(3)以上化学方程式也有许多不同之处,请你写出其中一个与另两个的一点不同之处______.
(4)某同学取一段纱窗网上的细铁丝,在自己收集到的氧气中做“铁丝在氧气中燃烧”的实验,结果没有观察到“火星四射”的现象.请分析此实验失败的两种可能原因:______、______.后经改进实验成功了,在进行该实验时必须在瓶底铺一层细沙或装少量水,目的是______.______.
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。

(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
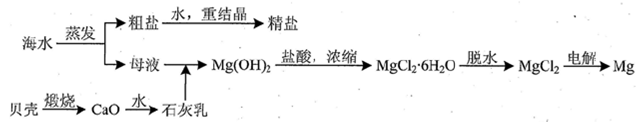
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。
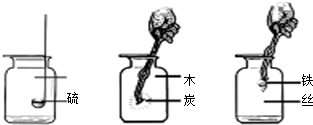
(1)写出上述三个反应化学方程式
①
| ||
| ||
②
| ||
| ||
③
| ||
| ||
(2)比较上述三个反应,发现它们有许多共同点:请你写出其中两点:
①
(3)以上化学方程式也有许多不同之处,请你写出其中一个与另两个的一点不同之处
(4)某同学取一段纱窗网上的细铁丝,在自己收集到的氧气中做“铁丝在氧气中燃烧”的实验,结果没有观察到“火星四射”的现象.请分析此实验失败的两种可能原因: