网址:http://m.1010jiajiao.com/timu3_id_341256[举报]
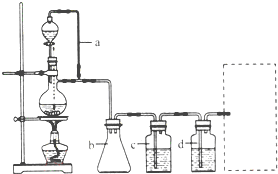 (2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
(2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH=CH2+CO+H2
| 一定条件 |
| ||
| Ni,△ |
CO的制备原理:HCOOH
| ||
| △ |
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:
| 催化剂 |
| 催化剂 |
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是

(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品.为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇 118℃,并设计出如下提纯路线:

试剂1为
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,用所给的试剂,按滴加顺序依次为
_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1NaCl溶液,所用仪器出药匙、玻璃棒外还有
_________。
a、天平 b、烧杯 c 、锥形瓶 d 、500 mL容量瓶 e、250 mL容量瓶 f、胶头滴管 g、移液管
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是_______________。此副反应的产物之一是84消毒液的主要成分,其消毒的原理是______________________。
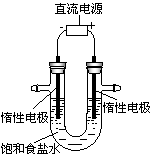
 MnCl2+Cl2↑+2H2O据此,制备并收集干燥、纯净Cl2的装置是__________(填代号)。
MnCl2+Cl2↑+2H2O据此,制备并收集干燥、纯净Cl2的装置是__________(填代号)。 
(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是 (只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要 (填仪器名称);若定容时仰视刻度线,则所配溶液的浓度 (填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为 ,同样条件下收集的Cl2 (填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为: ;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置 (填代号)
可选用制备气体的装置:
所选装置中的两个洗气瓶里应依次盛装 、 (填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由 ;尾气用 溶液(填化学式)吸收,写出发生反应的离子方程式 。
查看习题详情和答案>>
(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液 、 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是 (只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要 (填仪器名称);若定容时仰视刻度线,则所配溶液的浓度 (填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为 ,同样条件下收集的Cl2 (填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为: ;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置 (填代号)
可选用制备气体的装置:
所选装置中的两个洗气瓶里应依次盛装 、 (填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由 ;尾气用 溶液(填化学式)吸收,写出发生反应的离子方程式 。
(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液 、 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是 (只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要 (填仪器名称);若定容时仰视刻度线,则所配溶液的浓度 (填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为 ,同样条件下收集的Cl2 (填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为: ;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置 (填代号)
可选用制备气体的装置:

所选装置中的两个洗气瓶里应依次盛装 、 (填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由 ;尾气用 溶液(填化学式)吸收,写出发生反应的离子方程式 。
查看习题详情和答案>>