摘要:主观原因 产生误差的原因 m(H2O)/m(CuSO4)的值 X值 称量的坩埚不干燥 变大 偏大 坩埚内附有不挥发性杂质 无影响 无影响 加热后.未放入干燥器中冷却 变小 偏低 晶体未完全变白停止加热 变小 偏低 加热温度过高.晶体部分变黑 变大 偏大 加热时有少量晶体溅出 变大 偏大
网址:http://m.1010jiajiao.com/timu3_id_341127[举报]
某化学兴趣小组在学习分散系时,对氢氧化铁胶体产生了兴趣:为什么氯化铁溶液和氢氧化钠混合会产生氢氧化铁沉淀,而把氯化铁溶液逐滴加到沸水中却得到的是氢氧化铁胶体且外观上和溶液没有区别?胶体分散质粒子直径比浊液分散质粒子直径要小,同样是氢氧化铁,为什么胶体中不能聚集成更大的粒子而沉淀呢?带着疑问,兴趣小组进行了探究实验:
(1)I组用普通滤纸分别对氢氧化铁浊液和氢氧化铁胶体进行了过滤实验,结果发现浊液过滤器的滤纸上留有红棕色固体,而胶体过滤器的滤纸上没有固体留下。由此,I组同学得出结论:__________________________________。
(2)II组取氢氧化铁胶体于烧杯中,插上电极,接通直流电源,想实验看胶体是否和电解质溶液一样具有导电性。结果却意外的发现,氢氧化铁胶体的红褐色在接电源负极一极明显加深,而接电源正极一极却明显变浅了。由此II组同学得出初步结论:氢氧化铁胶体粒子可能是带______________粒子。进一步得出结论:正是由于这个原因产生的________________作用而使氢氧化铁胶体不容易聚集而沉淀。
(3)辅导老师根据II组得出的结论,又做了一个实验:往氢氧化铁胶体中逐滴滴加一种溶液,结果开始时产生沉淀,继续滴加时沉淀又溶解。老师滴加的溶液是______________(填序号)
A.2mol/L 溶液 B.2mol/L NaOH溶液 C.2mol/L
溶液 B.2mol/L NaOH溶液 C.2mol/L  溶液 D.硅酸胶体
溶液 D.硅酸胶体
先产生沉淀的原因可能是_______________,请写出沉淀溶解的离子方程式__________________。
(4)辅导老师根据II组得出的结论,又做了一个实验:往氢氧化铁胶体中逐滴滴加HI溶液。观察现象为:开始时出现红褐色沉淀,随后沉淀溶解,溶液呈黄色,最后溶液颜色加深。
完成离子反应: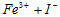 =__________________。请推测HI应具有___________、__________;
=__________________。请推测HI应具有___________、__________; 具有____________。
具有____________。
查看习题详情和答案>>
(1)I组用普通滤纸分别对氢氧化铁浊液和氢氧化铁胶体进行了过滤实验,结果发现浊液过滤器的滤纸上留有红棕色固体,而胶体过滤器的滤纸上没有固体留下。由此,I组同学得出结论:__________________________________。
(2)II组取氢氧化铁胶体于烧杯中,插上电极,接通直流电源,想实验看胶体是否和电解质溶液一样具有导电性。结果却意外的发现,氢氧化铁胶体的红褐色在接电源负极一极明显加深,而接电源正极一极却明显变浅了。由此II组同学得出初步结论:氢氧化铁胶体粒子可能是带______________粒子。进一步得出结论:正是由于这个原因产生的________________作用而使氢氧化铁胶体不容易聚集而沉淀。
(3)辅导老师根据II组得出的结论,又做了一个实验:往氢氧化铁胶体中逐滴滴加一种溶液,结果开始时产生沉淀,继续滴加时沉淀又溶解。老师滴加的溶液是______________(填序号)
A.2mol/L
 溶液 B.2mol/L NaOH溶液 C.2mol/L
溶液 B.2mol/L NaOH溶液 C.2mol/L  溶液 D.硅酸胶体
溶液 D.硅酸胶体先产生沉淀的原因可能是_______________,请写出沉淀溶解的离子方程式__________________。
(4)辅导老师根据II组得出的结论,又做了一个实验:往氢氧化铁胶体中逐滴滴加HI溶液。观察现象为:开始时出现红褐色沉淀,随后沉淀溶解,溶液呈黄色,最后溶液颜色加深。
完成离子反应:
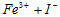 =__________________。请推测HI应具有___________、__________;
=__________________。请推测HI应具有___________、__________; 具有____________。
具有____________。
近年来,我国部分地区多次陷入严重雾霾之中,其中一个重要的原因是我国的能源消费结构以燃煤为主,改变煤的利用方式可减少环境污染.以下是对煤进行处理的方法:
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在 下能自发进行(填“高温”或“低温”);
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 .(已知:H2S Ka1=9.1×10-8;Ka2=1.1×10-12 H2CO3 Ka1=4.30×10-7;Ka2=5.61×10-11)
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
①一步法合成二甲醚:3H2(g)+3CO(g)=CH3OCH3(g)+CO2 (g)△H= .
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是 (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:
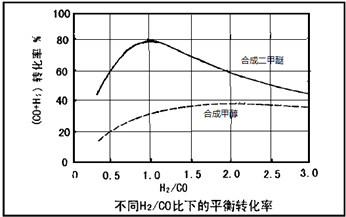
①合成二甲醚的最佳H2/CO比为 .对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),写出“一步法”合成二甲醚的KP= ,提高H2/CO比,则KP (填“变大”、“变小”或“不变”)
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率 .
查看习题详情和答案>>
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:

①合成二甲醚的最佳H2/CO比为
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是
制乙酸、催化剂、吸水剂
制乙酸、催化剂、吸水剂
;反应化学方程式:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O;
| 浓硫酸 |
| △ |
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O;
.| 浓硫酸 |
| △ |
(2)球形干燥管C的作用是
防止倒吸、冷凝
防止倒吸、冷凝
.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅
溶液分层,上层无色油体液体,下层溶液颜色变浅
.(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出
乙醇
乙醇
;再加入(此空从下列选项中选择)C
C
,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐.工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐.
已知:SrSO4(s)?Sr2+(aq)+SO2-4(aq) KSP=2.5×10-7
SrSO3(s)?Sr2+(aq)+CO2-4(aq) KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 .(用沉淀溶解再平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率.判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将 ;
②增大CO2-3的浓度,平衡常数K将 .
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3.实验所用试剂为 ;实验现象及其相应结论 .
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂.某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4.你认为该推理是否严密?试说明理由.
查看习题详情和答案>>
已知:SrSO4(s)?Sr2+(aq)+SO2-4(aq) KSP=2.5×10-7
SrSO3(s)?Sr2+(aq)+CO2-4(aq) KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率.判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将
②增大CO2-3的浓度,平衡常数K将
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3.实验所用试剂为
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂.某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4.你认为该推理是否严密?试说明理由.