网址:http://m.1010jiajiao.com/timu3_id_341123[举报]
| ||
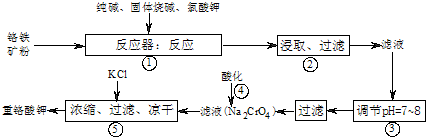
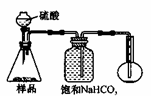
(1)在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2.Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅.氧化铝分别与碳酸钠反应其中一个的化学方程式:
| ||
或Al2O3+Na2CO3
| ||
| ||
或Al2O3+Na2CO3
| ||
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
(3)操作③的目的是(用简要的文字和化学方程式说明):
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(5)称取重铬酸钾试样m g配成VmL溶液,取出V1 mL于碘量瓶中,加入适量的稀H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水和3mL淀粉作指示剂,用c mol/LNa2S2O3标准溶液滴定(相关反应为:
Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O.I2+2S2O32-=2I-+S4O62-,K2Cr2O7式量为294.则:
①滴定时用到的玻璃仪器有(写仪器名称)
②判断达到滴定终点的依据是:
③设整个过程中其它杂质不参与反应.若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品的中重铬酸钾的纯度的代数式为(不必化简)
| 294×c×V×V2 |
| 6×1000×V1×m |
| 294×c×V×V2 |
| 6×1000×V1×m |
 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有
②滴定时选择的指示剂为甲基橙.当溶液
③为减少偶然误差,通常的处理办法是
④滴定时若锥形瓶内有少量液体溅出,则测定结果
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为
| 53(W3-W1) |
| 22W2 |
| 53(W3-W1) |
| 22W2 |
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是
工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答31-34小题:
方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
方案二的具体过程为:
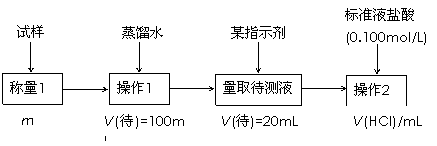 |
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
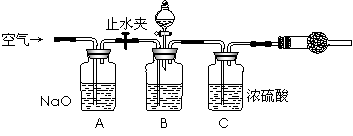 方案三的实验装置如下图:
方案三的实验装置如下图:
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)
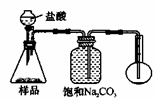
A B


C D
查看习题详情和答案>>(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图:

操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)
A B
C D
查看习题详情和答案>>
(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为: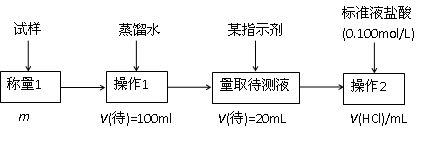
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图: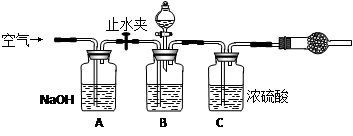
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)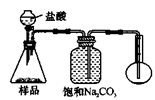
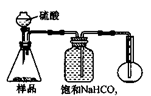
A B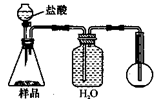
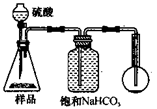
C D