摘要:蒸发皿 (1)识别 如图所示.蒸发皿届瓷质仪器. (2)用途 用作蒸发.浓缩溶液或干炒固体等. (3)使用方法 ①所盛液体不超过容积的2/3. ②加热时直接放在铁因或泥三角上. ③可直接加热.高温时须用坩埚取放.不能骤冷. ④加热过程中.用玻璃棒不断搅动.防止由于局部温度过高.造成液体飞溅. ⑤当蒸发皿中出现较多量的固体时.即停止加热.此时.可利用余热将溶液蒸发至干. [例23]下列盛液体的仪器加热时.不需用石棉网的是( ). (A)锥形瓶 烧杯 (D)蒸馏烧瓶 [例24]根据从草木灰中提取钾盐的实验.填写下列空白. (1)此实验操作顺序如下: ①称量样品,②溶解.沉淀,③ ,④ ,⑤冷却结晶. (2)用托盘天平称量样品时.若指针偏向右边.则表示 左盘轻.砝码重 右盘轻.样品重 (3)在进行第③步操作时.有时可能要重复进行.这是由于 o (4)在进行第④步操作时.要用玻璃捧不断小心地搅动液体.目的是防止 . (5)所得产物中主要的钾盐有 等.
网址:http://m.1010jiajiao.com/timu3_id_340862[举报]
|
实验室进行Na2SO4溶液蒸发时,一般有下列操作过程,其正确的操作顺序为: ①固定铁圈位置 ②停止加热,余热蒸干 ③放置酒精灯 ④放蒸发皿 ⑤加热搅拌 | |
| [ ] | |
A. |
①③④⑤② |
B. |
③①④⑤② |
C. |
①④③⑤② |
D. |
③④①⑤② |
(2010?定海区模拟)某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
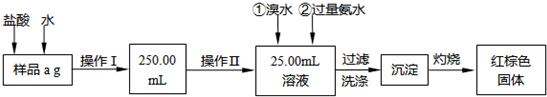
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式
(3)检验沉淀是否已经洗涤干净的操作是
(4)将沉淀物加热,冷却至室温,用托盘天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是
×100%
×100%(列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是
查看习题详情和答案>>

请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
,(填仪器名称)操作II必须用到的仪器是D
D
.(填编号)A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式
2Fe2++Br2=2Fe3++2Br-
2Fe2++Br2=2Fe3++2Br-
,加入氨水要过量的原因是使Fe3+充分沉淀
使Fe3+充分沉淀
.(3)检验沉淀是否已经洗涤干净的操作是
取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
.(4)将沉淀物加热,冷却至室温,用托盘天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是
再次加热冷却并称量,直至两次质量差小于0.1g
再次加热冷却并称量,直至两次质量差小于0.1g
.(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是
| 112(W2-W1) |
| 160a |
| 112(W2-W1) |
| 160a |
固体加热时未充分反应变为Fe2O3
固体加热时未充分反应变为Fe2O3
.(写出一种原因即可). ⑤
⑤