摘要:13.C 14.C 15.C 16.D 17.C 18.B
网址:http://m.1010jiajiao.com/timu3_id_338909[举报]
下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号.请参照元素A~J在周期表中的位置,回答下列问题:
(1)上表中元素的最高价氧化物对应的水化物中碱性最强的是
(2)J的原子结构示意图为
 ;C在周期表的第
;C在周期表的第
(3)最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是
(4)D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)
(5)写出化学方程式:①用电解法冶炼G
②都含有A、F、D、E四种元素的两种盐溶液相互反应
(6)请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)
(7)G元素既表现金属性又有一定的非金属性,请用AlCl3溶液、NaOH溶液设计实验证明(要求写出步骤、现象、离子反应程式)
查看习题详情和答案>>
| 纵行 横行 |
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | F | G | H | E | I | J |
NaOH
NaOH
(用化学式表示)、酸性最强的是HClO4
HClO4
(用化学式表示);(2)J的原子结构示意图为


VA
VA
族;(3)最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是
N
N
;(4)D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)
S2-
S2-
>02-
02-
>Na+
Na+
>Al3+
Al3+
;(5)写出化学方程式:①用电解法冶炼G
2Al2O3
4Al+302
| ||
2Al2O3
4Al+302
;
| ||
②都含有A、F、D、E四种元素的两种盐溶液相互反应
NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O
NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O
.(6)请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)
2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
.(7)G元素既表现金属性又有一定的非金属性,请用AlCl3溶液、NaOH溶液设计实验证明(要求写出步骤、现象、离子反应程式)
向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,然后又逐渐溶解
向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,然后又逐渐溶解
;Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=[Al(OH)4]-
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=[Al(OH)4]-
.下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号.请参照元素A~J在周期表中的位置,回答下列问题:
(1)上表中元素的最高价氧化物对应的水化物中碱性最强的是______(用化学式表示)、酸性最强的是______(用化学式表示);
(2)J的原子结构示意图为______;C在周期表的第______族;
(3)最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是______;
(4)D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)______>______>______>______;
(5)写出化学方程式:①用电解法冶炼G______;
②都含有A、F、D、E四种元素的两种盐溶液相互反应______.
(6)请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)______.
(7)G元素既表现金属性又有一定的非金属性,请用AlCl3溶液、NaOH溶液设计实验证明(要求写出步骤、现象、离子反应程式)______;______.
查看习题详情和答案>>
| 纵行 横行 |
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | F | G | H | E | I | J |
(2)J的原子结构示意图为______;C在周期表的第______族;
(3)最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是______;
(4)D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)______>______>______>______;
(5)写出化学方程式:①用电解法冶炼G______;
②都含有A、F、D、E四种元素的两种盐溶液相互反应______.
(6)请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)______.
(7)G元素既表现金属性又有一定的非金属性,请用AlCl3溶液、NaOH溶液设计实验证明(要求写出步骤、现象、离子反应程式)______;______.
下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号.请参照元素A~I在周期表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是______(写出元素名称),请设计一个简单的实验证明这一结论______.
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式______.
(3)I元素在周期表中的位置是第______周期、第______族.
(4)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和2:1的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
查看习题详情和答案>>
| 纵行 横行 |
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式______.
(3)I元素在周期表中的位置是第______周期、第______族.
(4)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和2:1的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是______(写出元素名称),请设计一个简单的实验证明这一结论______.
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
______
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
(4)I元素在周期表里的位置在第______周期、第______族.
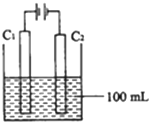
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式______.
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(KW=1.00×10-14)
查看习题详情和答案>>
| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
______
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
(4)I元素在周期表里的位置在第______周期、第______族.

实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式______.
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(KW=1.00×10-14)
下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是______(写出元素名称),请设计一个简单的实验证明这一结论______.
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
______
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
(4)I元素在周期表里的位置在第______周期、第______族.
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式______.
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(KW=1.00×10-14)
 查看习题详情和答案>>
查看习题详情和答案>>
| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
______
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
(4)I元素在周期表里的位置在第______周期、第______族.
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式______.
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(KW=1.00×10-14)
 查看习题详情和答案>>
查看习题详情和答案>>