网址:http://m.1010jiajiao.com/timu3_id_337773[举报]
(14分)已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:
FeS+H2SO4=FeSO4+H2S↑ Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S+2H2O
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:
⑴装置A是由双孔塞、玻璃导管及 和 组装起来的
⑵组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性
①按实验装置连接顺序,把a f各导管口连接起来,正确的顺序有
f各导管口连接起来,正确的顺序有
| A.befcda | B.adcefb | C.acdfeb | D.acdefb |
③若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生 现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用 。 查看习题详情和答案>>
(14分)已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:
FeS+H2SO4=FeSO4+H2S↑ Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S+2H2O
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:

⑴装置A是由双孔塞、玻璃导管及 和 组装起来的
⑵组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性
①按实验装置连接顺序,把a f各导管口连接起来,正确的顺序有
f各导管口连接起来,正确的顺序有
A.befcda B.adcefb C.acdfeb D.acdefb
②若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有还原性;
③若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生 现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用 。
查看习题详情和答案>>
已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有 。
(3)沉淀反应中所加的试剂R可以是下列试剂中的
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指____________________________________________ _;
第③步物品之所以放在该仪器中进行实验的原因是 。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
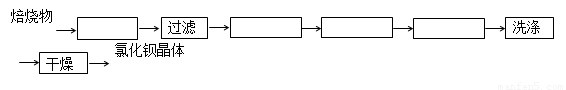
(方框内填写操作名称)
查看习题详情和答案>>
①FeS不溶解于水;
②实验室制取H2S、SO2气体的原理是:
FeS+H2SO4=FeSO4+H2S↑
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S↓+2H2O。
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:

(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性。
①按实验装置连接顺序,把a→f各导管口连接起来,正确的顺序有 。
A.befcda B.adcefb C.acdfeb D.acdefb
②若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有还原性;
③若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生 现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用 。
根据下图中A—D的实验装置和试剂进行实验,完成下列问题:

(1)装置A是由双孔塞、玻璃导管及____________和____________组装起来的。
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性和漂白性。
①按实验装置连接顺序,把a→f各导管口连接起来,正确的顺序有____________。
A.befcda B.adcefb C.acdfeb D.acdefb
②若C装置中的溶液为____________,反应后该溶液变为无色,说明SO2具有还原性。
③若C装置中的溶液为____________,反应后该溶液变为无色,说明SO2具有漂白性。
④当D中产生_______________________________________现象时,说明SO2具有氧化性。
(3)D装置烧杯中NaOH溶液的作用是_____________________________________________。
查看习题详情和答案>>