网址:http://m.1010jiajiao.com/timu3_id_337597[举报]
(8分) 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性分子可用作某些化学反应的催化剂,为合成对人类有用的重要化学物开辟了一个全新的研究领域。在有机物分子中,若某个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如: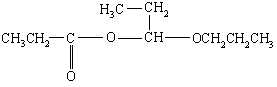 。若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在。某链烃C7H10。的众多同分异构体中:
。若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在。某链烃C7H10。的众多同分异构体中:
(1) 处于同一平面上的碳原子数最多有 个。
(2) 含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的有多种。它们的结构简式除2种外,再写出3种
![]() 、
、![]()
 、 。
、 。
(3) 含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是 。
查看习题详情和答案>>(8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
(选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
C-H |
Cl-Cl |
C—Cl |
H—Cl |
|
键能/ kJ·mol–1 |
X |
243 |
330 |
432 |
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,则上表中X= 。
查看习题详情和答案>>
(8分)2009年“六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
①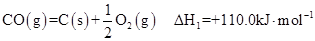
②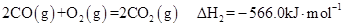
请回答下列问题:
(1)反应①的熵变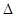 S (填“>”或“<”)0。
S (填“>”或“<”)0。
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行? (填“可行”或“不可行”)。
(3)反应②中的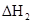 是不是CO的燃烧热?
(填“是”或“不是”)。
是不是CO的燃烧热?
(填“是”或“不是”)。
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12 g C(s)完全燃烧生成CO2(g)时,放出的热量为 kJ(依据反应①、②计算)。
查看习题详情和答案>>
(8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
(选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C—Cl | H—Cl |
| 键能/ kJ·mol–1 | X | 243 | 330 | 432 |
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,则上表中X= 。 查看习题详情和答案>>
 六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应: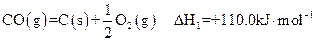
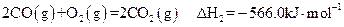
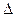 S (填“>”或“<”)0。
S (填“>”或“<”)0。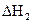 是不是CO的燃烧热? (填“是”或“
是不是CO的燃烧热? (填“是”或“ 不是”)。
不是”)。