网址:http://m.1010jiajiao.com/timu3_id_336472[举报]
 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有
②滴定时选择的指示剂为甲基橙.当溶液
③为减少偶然误差,通常的处理办法是
④滴定时若锥形瓶内有少量液体溅出,则测定结果
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为
| 53(W3-W1) |
| 22W2 |
| 53(W3-W1) |
| 22W2 |
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是
2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H<0.回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ.2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
反应Ⅱ.NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2>0
下列示意图1中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号)
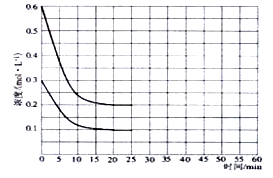
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图2所示.
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为
②为提高尿素的产率,下列可以采取的措施有
A.缩小反应容器的容积B.升高温度
C.平衡体系中及时分离出CO(NH2)2D.使用合适的催化剂
③该反应的平衡常数表达式K=
④若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正
若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线.

尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1< 0
NH2COONH4(s) ΔH1< 0
反应Ⅱ:NH2COONH4(s)  CO(NH2)2(l)+ H2O (l) ΔH 2> 0
CO(NH2)2(l)+ H2O (l) ΔH 2> 0
(1)下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。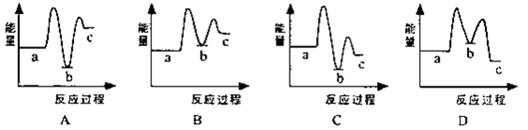
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)①从图中得知?c(CO2)=0.2mol/L,则v(CO2)= ?c(CO2)/t= 0.01mol·L-1·min-1。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
| A.缩小反应容器的容积 |
| B.升高温度 |
| C.平衡体系中及时分离出CO(NH2)2 |
| D.使用合适的催化剂 |
(填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。
 查看习题详情和答案>>
查看习题详情和答案>>
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g)
 CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2COONH4(s)
ΔH1< 0
NH2COONH4(s)
ΔH1< 0
反应Ⅱ:NH2COONH4(s)  CO(NH2)2(l)+ H2O (l) ΔH 2> 0
CO(NH2)2(l)+ H2O (l) ΔH 2> 0
(1)下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。
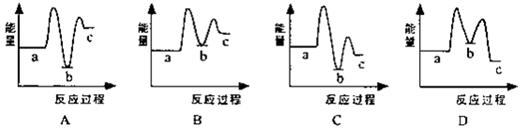
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)①从图中得知?c(CO2)=0.2mol/L,则v(CO2)= ?c(CO2)/t= 0.01mol·L-1·min-1。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
A.缩小反应容器的容积
B.升高温度
C.平衡体系中及时分离出CO(NH2)2
D.使用合适的催化剂
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将
(填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。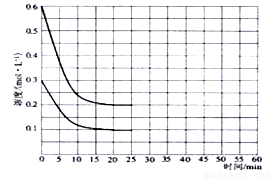
查看习题详情和答案>>
新华网2月22日电 截至22日15时,山西屯兰煤矿事故已造成73人遇难。据事故抢险指挥部介绍,现已初步查明,事故原因为井下局部瓦斯爆炸。该矿发生事故时井下共有矿工436人,有375人陆续升井。升井后经抢救无效死亡的和井下已发现遇难遗体的矿工共计73人。现有113人住院观察,其中21人伤势较重。目前,山西仍在全力搜救被困者,第一轮搜救已于14时结束,目前第二轮搜救排查已经展开,同时山西省还采取措施防止次生灾害发生。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。
![]() ⑴下列关于甲烷的叙述中错误的是( )
⑴下列关于甲烷的叙述中错误的是( )
![]() A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子
A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子
![]() B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
![]() C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
![]() D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
![]() ⑵已知某正四面体形分子E和直线形分子G在光照条件下反应,生成一种直线形分子M和变形的四面体L(组成E.G.L.M分子的元素原子序数均小于18),且G分子中的原子处于E分子最大原子的下一周期。反应过程图示如下:
⑵已知某正四面体形分子E和直线形分子G在光照条件下反应,生成一种直线形分子M和变形的四面体L(组成E.G.L.M分子的元素原子序数均小于18),且G分子中的原子处于E分子最大原子的下一周期。反应过程图示如下:
![]()
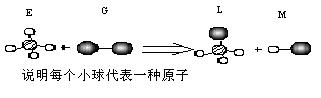
![]() 利用E与G发生取代反应制取副产品M溶液的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
利用E与G发生取代反应制取副产品M溶液的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
![]()
![]()

根据要求填空:
![]() ①B装置有三种功能:①控制气流速度;②均匀混合气体;③
①B装置有三种功能:①控制气流速度;②均匀混合气体;③
![]() ②设V(G)/V(E)=x,若理论上欲获得最多的M,则x值应
②设V(G)/V(E)=x,若理论上欲获得最多的M,则x值应
![]() ③D装置的石棉中均匀混有KI粉末,其作用是 。
③D装置的石棉中均匀混有KI粉末,其作用是 。
![]() ④E装置的作用是 (填编号)
④E装置的作用是 (填编号)
![]() A.收集气体 B.吸收G物质 C.防止倒吸 D.吸收M物质
A.收集气体 B.吸收G物质 C.防止倒吸 D.吸收M物质
![]() ⑤在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
⑤在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
![]() ⑥E装置出生成盐酸外,还含有有机物,从E中分离出M的最佳方法为 。
⑥E装置出生成盐酸外,还含有有机物,从E中分离出M的最佳方法为 。
![]() 该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为