摘要:17.1.92gCu投入一定量的浓硝酸溶液中.铜完全溶解.生成气体的颜色越来越浅.共收集到S.P.T时672mL气体.将盛有此气体的容器倒扣在水中.通入标况下一定量体积的氧气恰好使气体完全溶于水.则通入氧气的体积是 A.504mL B.168mL C.224mL D.336mL
网址:http://m.1010jiajiao.com/timu3_id_336293[举报]
哈三中某课外活动小组改进铜与浓硫酸反应的实验,制备并验证二氧化硫的性质,请回答下列问题:
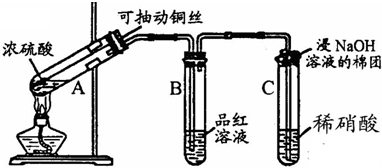
(1)铜丝在实验中的作用:
(2)实验过程中在装置C中会看到什么现象?
(3)已知反应:2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=
若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡
但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度
查看习题详情和答案>>

(1)铜丝在实验中的作用:
控制反应的开始和停止
控制反应的开始和停止
.(2)实验过程中在装置C中会看到什么现象?
生成无色气体并变为红棕色
生成无色气体并变为红棕色
;请用化学方程式解释:SO2+HNO3=H2SO4+NO2NO+02=2NO2
SO2+HNO3=H2SO4+NO2NO+02=2NO2
.(3)已知反应:2SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是C
C
.A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=
0.06mol/L?min-1
0.06mol/L?min-1
.若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡
不移动
不移动
(填“正向移动”、“逆向移动”、“不移动”、“无法确定”).但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度
减小
减小
.(填“填大”、“不变”或“减小”),O2的转化率减小
减小
(填“升高”、“不变”或“降低”),SO2的体积分数减小
减小
(填“增大”、“不变”或“减小”).已知以下信息:
①1mol N2的共价键断裂吸收946kJ的能量;1mol H2的共价键断裂吸收436kJ的能量;形成1mol NH3中的化学键释放1173kJ的能量.
②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
根据以上相关数据回答问题:
(1)用H2表示该反应2s内的平均反应速率为
(2)
(3)写出该反应的化学方程式
(4)氮气和氢气生成氨气的过程
查看习题详情和答案>>
①1mol N2的共价键断裂吸收946kJ的能量;1mol H2的共价键断裂吸收436kJ的能量;形成1mol NH3中的化学键释放1173kJ的能量.
②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
| N2(mol?L-1) | H2(mol?L-1) | NH3(mol?L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
(1)用H2表示该反应2s内的平均反应速率为
0.6 mol?L-1?s-1
0.6 mol?L-1?s-1
(2)
不能
不能
(填“能”或“不能”)确认该反应2s末已达化学平衡状态.(3)写出该反应的化学方程式
N2+3H2  2NH3
2NH3
 2NH3
2NH3N2+3H2  2NH3
2NH3
 2NH3
2NH3(4)氮气和氢气生成氨气的过程
释放
释放
(填“释放”或“吸收”)能量.一定条件下将1mol A和1mol B投入一密闭容器中发生如下反应A(g)+B(g)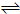 xC(g)达到平衡时,C的体积分数为W%,生成C为amol.当再投1mol A和1mol B重新达平衡.请用大于、小于、等于或不能确定填写在下列条件下从新达到平衡的结果.
xC(g)达到平衡时,C的体积分数为W%,生成C为amol.当再投1mol A和1mol B重新达平衡.请用大于、小于、等于或不能确定填写在下列条件下从新达到平衡的结果.
(1)若x=1,在恒温恒容时,共有C
(2)若x=1,在恒温恒压时,共有C
(3)若x=2,共有C
(4)若x=3,在恒温恒容时,共有C
查看习题详情和答案>>
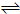 xC(g)达到平衡时,C的体积分数为W%,生成C为amol.当再投1mol A和1mol B重新达平衡.请用大于、小于、等于或不能确定填写在下列条件下从新达到平衡的结果.
xC(g)达到平衡时,C的体积分数为W%,生成C为amol.当再投1mol A和1mol B重新达平衡.请用大于、小于、等于或不能确定填写在下列条件下从新达到平衡的结果.(1)若x=1,在恒温恒容时,共有C
大于
大于
2amol,C的体积分数大于
大于
W%.(2)若x=1,在恒温恒压时,共有C
等于
等于
2amol,C的体积分数等于
等于
W%.(3)若x=2,共有C
等于
等于
2amol,C的体积分数等于
等于
W%.(4)若x=3,在恒温恒容时,共有C
小于
小于
2amol,C的体积分数小于
小于
W%.金属元素及其化合物在科学研究和生产生活中有着广泛的用途。
(1)现有一种铜粉与氧化铜粉末的混合物。经测定,该混合物中铜元素与氧元素的质量之比为5:1。该混合物中铜与氧化铜的物质的量之比为 。
(2)取铝合金(含铝90%)1.5 g 与80 mL 3mol•L-1 盐酸充分反应(合金中其它成分不参加反应)。滤去不溶物,将滤液稀释到100mL,取出稀释液5mL,加入0.6 mol•L-1 的氨水使Al3+ 恰好完全沉淀。
上述铝合金和盐酸反应的过程中生成氢气_________L(标准状况)。使Al3+ 恰好完全沉淀时,消耗氨水_________mL。
(3)将1.84g金属钠投入98.16 g水中,向反应后的溶液里通入一定量的CO2(g),将溶液小心蒸干。计算可得固体质量的最大值。
(4)向a mL 0.8mol•L-1 NaOH(aq) 中通入b mol CO2(g),反应所得混合液的成份随b的物质的量的不同而不同。请通过计算完成下表:(溶质的质量用含a、b的代数式表示)
|
b的取值范围(mol) |
溶质的成份 |
溶质的质量(g) |
|
b<4a×10- 4 |
|
|
|
|
Na2CO3、NaHCO3 |
|
查看习题详情和答案>>