网址:http://m.1010jiajiao.com/timu3_id_336276[举报]
I.将状况相同的某种绿叶分成四等组,在不同温度下分别暗处理1h,再用适当的相同的光照射1h,测其重量变化(假设在光下和黑暗条件下,细胞呼吸消耗有机物量相同),得到如下表的数据。分析并回答问题:
|
组 别 |
1 |
2 |
3 |
4 |
|
温度/℃ |
27 |
28 |
29 |
30 |
|
暗处理后重量变化/mg |
-1 |
-2 |
-3 |
-1 |
|
光照后与暗处理前 重量变化/mg |
+3 |
+3 |
+3 |
+1 |
(1)该探究实验中,属于因变量的有 、 。
(2)第一组实验说明该绿叶在27℃时每小时积累的有机物的量是___________mg;29℃时真实光合速率为_______________mg/h。
Ⅱ.(7分)已知 ,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
实验材料与用具:适宜浓度的H2O2溶液,蒸馏水,3.5% 溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
(1)实验步骤:
①取3支试管,各加入等量且适量的H2O2溶液,放入37℃恒温水浴锅中保温适当时间,
② ,
③观察各管中释放气泡产生的快慢。
(2)实验结果预测及结论:
整个实验中不同处理的试管中O2的释放速度从快到慢依次是:________________ 。
由此可得出的结论是____________________________________。
(3)如果仅将实验中的恒温水浴改为80℃,重做上述实验,O2释放的速度最快的是_____________。
查看习题详情和答案>>
I.将状况相同的某种绿叶分成四等组,在不同温度下分别暗处理1h,再用适当的相同的光照射1h,测其重量变化(假设在光下和黑暗条件下,细胞呼吸消耗有机物量相同),得到如下表的数据。分析并回答问题:
| 组 别 | 1 | 2 | 3 | 4 |
| 温度/℃ | 27 | 28 | 29 | 30 |
| 暗处理后重量变化/mg | -1 | -2 | -3 | -1 |
| 光照后与暗处理前 重量变化/mg | +3 | +3 | +3 | +1 |
(1)该探究实验中,属于因变量的有 、 。
(2)第一组实验说明该绿叶在27℃时每小时积累的有机物的量是___________mg;29℃时真实光合速率为_______________mg/h。
Ⅱ.(7分)已知![]() ,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
实验材料与用具:适宜浓度的H2O2溶液,蒸馏水,3.5%![]() 溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
(1)实验步骤:
①取3支试管,各加入等量且适量的H2O2溶液,放入37℃恒温水浴锅中保温适当时间,
② ,
③观察各管中释放气泡产生的快慢。
(2)实验结果预测及结论:
整个实验中不同处理的试管中O2的释放速度从快到慢依次是:________________ 。
由此可得出的结论是____________________________________。
(3)如果仅将实验中的恒温水浴改为80℃,重做上述实验,O2释放的速度最快的是_____________。
查看习题详情和答案>>
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJmol-1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
则a=
(2)冶炼铁反应的平衡常数表达式K=
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a~c装置中,能保护铁的是
②若用d装置保护铁,X极的电极材料应是

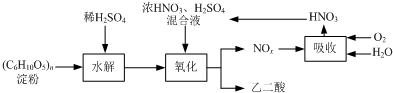
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为
(2)氧化时控制反应液温度为55~60℃的原因是
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中.则30kg淀粉可生产乙二酸的质量为
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2):n(NO)=2:1,且NOx的吸收转化率为90%.计算:理论上,每生产9kg 乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克.(写出计算过程)