网址:http://m.1010jiajiao.com/timu3_id_336222[举报]
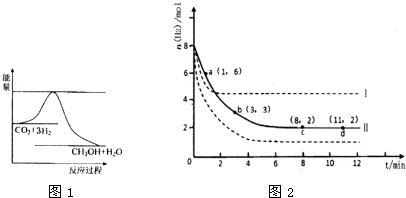
(1)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
①该反应是
②反应体系中加入催化剂对反应热是否有影响?
(2)若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线).
①该条件下反应的平衡常数K=
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图2中虚线所示,曲线I对应的实验条件改变是
③下列措施中能使H2转化率增大的是
A.升高温度 B.充入He(g),使体系压强增大 C.将H2O(g)从体系中分离出来 D.再充入3mol CO2
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.
已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ?mol-1
H2(g)+
| 1 | 2 |
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
(1)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N282%):
|
压强/MPa SO2转化率 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
②选择适应的催化剂,是否可以提高SO2的转化率?
③已知:2SO2(g)+O2(g)
| ||
| △ |
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土,拟在该地区建设大型炼铁厂.
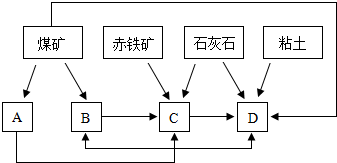
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定上图中相应工厂的名称B
②以赤铁矿为原料,写出高炉炼铁中得到生铁以及产生炉渣的化学方程式
| ||
| ||
| ||
| ||
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出1种措施即可)
已知:
(1)凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:

(2)
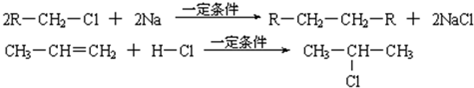
(3)合成路线如下:
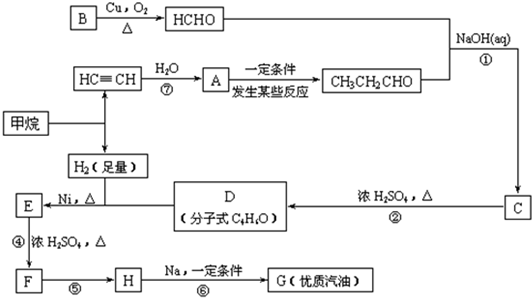
(1)写出D的结构简式
(2)在反应②~⑦中,属于加成反应的是
(3)写出下列反应方程式
E→F:
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
H→G:
| 一定条件 |
| 一定条件 |
(4)H也能与NaOH水溶液反应,其反应方程式为


(14分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判 断滴定终点。实验步骤如下:
断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。 如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
理由是 。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的 曲线图。
曲线图。
①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗2至3次,再用 ,然后才能盛放盐酸。滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol?L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确” 、“不正确”)
、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
(14分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
理由是 。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。

①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗2至3次,再用 ,然后才能盛放盐酸。滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol•L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确”、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
查看习题详情和答案>>