摘要:18.①分别用试管提取2mL的待测液.滴加氯化钡溶液至恰好完全反应. ②将两支试管中的液体分别加入对方试管的沉淀中.沉淀溶解.产生气体试管的原试剂为亚硫酸钠,没变化试管的原试剂为稀硫酸.
网址:http://m.1010jiajiao.com/timu3_id_336100[举报]
已知下列数据:
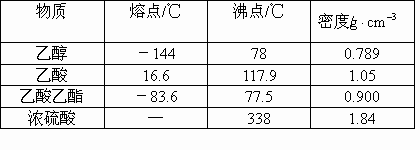
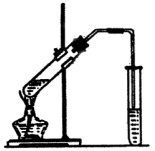
实验室制乙酸乙酯的主要步骤:
在30mL的大试管中按1:4:4的比例配制浓![]() 、乙醇和乙酸的混合液.
、乙醇和乙酸的混合液.
②如图5-22连接装置,使产生的蒸气经导管通到盛有4mL饱和![]() 溶液(加入滴酚酞试液的15mL试管中.)
溶液(加入滴酚酞试液的15mL试管中.)
③小火加热大试管中的混合物
④待小试管收集到约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层.
⑤分离纯净的乙酸乙酯
请回答下列问题:
(1)如何配制这一定比例的混合液________.
(2)写出该反应的化学方程式________反应中浓![]() 的作用是________.
的作用是________.
(3)在反应装置中,导气管出口的位置在![]() 液面上方2-3mm处,其理由是________;步骤③中为什么要小火加热________.
液面上方2-3mm处,其理由是________;步骤③中为什么要小火加热________.
(4)指出步骤④所观察到的现象是________.
原因与结论是________.
(5)为了提高乙酸乙酯的产率,甲、乙两同学分别设计了如图5-23、图5-24装置,乙同学待反应完毕后,放冷烧瓶中的液体,再用饱和![]() 溶液提取产物,你认为哪种装置合理?为什么?
溶液提取产物,你认为哪种装置合理?为什么?
(2012?河北模拟)当硝酸与金属或非金属反应时,反应物或反应条件不同,硝酸被还原的产物也不同.请回答下列问题:
(1)金属Zn与某浓度的硝酸反应时无气体产生,那么硝酸的还原产物为
(2)某混酸由200mL 3mol?L-1I的稀硝酸和200mL 2.5mol?L-1的稀硫酸均匀混合而成(忽略溶液的体积变化).将其分成两等份,分别与铜和铁反应,还原产物只有NO,则最多能溶解
(3)200mL 16mol?L-1的浓硝酸与3.2g Cu反应,反应过程中还原产物只有NO2,则反应结束后,产生气体的体积为
(4)用试管将(3)反应产生的NO2收集满并倒立在足量的水中,待试管中液面不再上升时,试管中剩余气体的体积约为原气体体积的
.试管中的液体的物质的量浓度为
查看习题详情和答案>>
(1)金属Zn与某浓度的硝酸反应时无气体产生,那么硝酸的还原产物为
NH3
NH3
(填化学式).(2)某混酸由200mL 3mol?L-1I的稀硝酸和200mL 2.5mol?L-1的稀硫酸均匀混合而成(忽略溶液的体积变化).将其分成两等份,分别与铜和铁反应,还原产物只有NO,则最多能溶解
0.3
0.3
mol Cu和16.8
16.8
g Fe.(3)200mL 16mol?L-1的浓硝酸与3.2g Cu反应,反应过程中还原产物只有NO2,则反应结束后,产生气体的体积为
2.24L
2.24L
(标准状况下),溶液中c(H+):c(NO-3)=30:31
30:31
(忽略HNO3的挥发).(4)用试管将(3)反应产生的NO2收集满并倒立在足量的水中,待试管中液面不再上升时,试管中剩余气体的体积约为原气体体积的
| 1 |
| 3 |
| 1 |
| 3 |
0.04mol/L
0.04mol/L
.(假设试管中的液体不对外扩散,此反应条件下1mol气体的体积为25.0L.如果NO2中混有N2O4气体,试管中的液体的物质的量浓度将增大
增大
(填“增大”、“减小”或“不变”).甲、乙、丙三位同学分别用如图所示三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:

(1)三位同学制取氨气的化学方程式为:
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作都正确),你认为没有收集到氨气的同学是
(3)检验氨气是否收集满的方法是
A、闻到有氨气逸出
B、棉花被气体冲出
C、用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D、用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(4)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是
查看习题详情和答案>>

(1)三位同学制取氨气的化学方程式为:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作都正确),你认为没有收集到氨气的同学是
乙
乙
(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是2NH3+H2SO4═(NH4)2SO4
2NH3+H2SO4═(NH4)2SO4
(用化学方程式表示).(3)检验氨气是否收集满的方法是
C
C
A、闻到有氨气逸出
B、棉花被气体冲出
C、用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D、用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(4)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是
丙
丙
(填“甲”、“乙”或“丙”).
碘元素有“智力元素”之称.研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量.
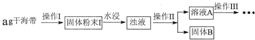
(1)操作Ⅰ为灼烧,则灼烧时用 盛装海带,操作Ⅱ为 ;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是 ;
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2
=2I-+
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为 ,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量 .(假设操作Ⅰ、Ⅱ过程中碘不损失,原子量I-127)
查看习题详情和答案>>

(1)操作Ⅰ为灼烧,则灼烧时用
(2)水浸时通常要将悬浊液煮沸2-3min,目的是
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2
| S2O | 2- 3 |
| S4O | 2- 6 |
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入 |
无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入 |
证明以I-形式存在 |
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为
 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.(1)实验前用碱液清洗铁钉,再用0.100mol/L的 H2SO4溶液浸泡至有气泡产生.用H2SO4溶液浸泡的目 的是
(2)为尽量减小误差,下列操作的正确顺序是
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为
(4)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH
假设二: NaCl溶液的浓度
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
| pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
| 液柱高度 | 0cm | 1.3cm | 8.5cm | 8.4cm | 8.5cm | 8.5cm |
| 形成稳定液柱时间 | 3.0min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | 17.5 min |
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是
③按上述实验装置,设计实验证明假设二.
第一步:
第二步:
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论.