网址:http://m.1010jiajiao.com/timu3_id_336031[举报]
(I)高铁酸钾(K2FeO4)是一种新型的高效氧化剂和消毒剂,用于饮用水处理.其工业制备用次氯酸钠、氢氧化钠溶液将硝酸铁氧化为高铁酸钠,然后用氢氧化钾转化为高铁酸钾.过滤得粗品,并用氢氧化钾溶液溶解,重结晶,用苯和95%乙醇进行脱碱、乙醚洗涤,干燥,制得高铁酸钾.请回答下列问题:
(1)写出工业制备次氯酸钠的离子反应方程式
(2)高铁酸钠与氢氧化钾反应转化为高铁酸钾,该反应能够发生的原因是
(Ⅱ)铜与浓硫酸反应因条件不同生成的产物不同.某同学做铜与浓硫酸反应的实验时,观察到如下现象:
①开始加热一会后先产生气泡,有细小黑色颗粒状物质从铜片表面进入浓硫酸中,形成黑色悬浊液.
②随着温度升高,铜片表面黑色颗粒消失,试管中产生了细小的白色颗粒状物质.
③继续加热至沸腾,其过程中也有气泡产生.停止加热静置,试管底部沉积的固体物质有黑色的和白色的,经检验黑色物质为硫化铜.
④将试管内的溶液倒入另一支试管中,溶液的蓝色不够明显.
请回答问题:
(1)请写出现象①的化学反应方程式
| ||
| ||
(2)写出③反应的化学方程式
| ||
| ||
(3)解释④现象产生的原因是
因此生成的CuSO4几乎没有水溶解,反应后试管中的液体几乎都是浓H2SO4而不是CuSO4溶液
因此生成的CuSO4几乎没有水溶解,反应后试管中的液体几乎都是浓H2SO4而不是CuSO4溶液
(Ⅲ)高锰酸钾是深紫色的针状晶体,是常用的氧化剂之一.
实验室可用软锰矿(主要成分是MnO2 )为原料制备高锰酸钾,基本过程如下:
(1)将软锰矿与KOH的混合物放入铁坩埚内,混合均匀,小火加热,并用铁棒搅拌,使混合物熔融,即可得绿色的K2MnO4.反应的化学方程式为2MnO2+4KOH+O2═2K2MnO4+2H2O实验中,不能将铁棒改为玻璃棒,理由是
(2)将K2MnO4溶于水,通入CO2气体发生反应可制得KMnO4,同时产生了黑色沉淀.该反应的化学方程式为
维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下:



A B C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有 (从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL (填仪器名称)定容配成100 mL稀橙汁。取洁净的 (从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入 中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是 溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是 。
(4)重复上述实验。
(5)数据记录和处理:
|
实验次数 |
稀橙汁体积(mL) |
滴定用标准碘(水)溶液(mL) |
|
1 |
25.00 |
23.10 |
|
2 |
25.00 |
23.00 |
|
3 |
25.00 |
22.90 |
从实验数据可知,该橙汁饮料中维生素C的含量为 mg·L-1
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果 (选填“偏高”或“偏低”或“无影响”)
查看习题详情和答案>>
下列有关实验基本操作的说法错误的是(?? )
A.存放浓硝酸时,使用带玻璃塞的棕色玻璃瓶
B.酸碱中和滴定时,若未用待测液润洗锥形瓶,对测定结果无影响
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出
D.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
查看习题详情和答案>>
维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下: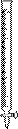
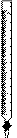
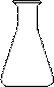
A B  C
C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有 (从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL (填仪器名称)定容配成100 mL稀橙汁。取洁净的 (从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入 中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是 溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是  。
。
(4)重复上述实验。
(5)数据记录和处理:
| 实验次数 | 稀橙汁体积(mL) | 滴定用标准碘(水)溶液(mL) |
| 1 | 25.00 | 23.10 |
| 2 | 25.00 | 23.00 |
| 3 | 25.00 | 22.90 |
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果 (选填“偏高”或“偏低”或“无影响”) 查看习题详情和答案>>