摘要:⑶ P(s) + 3/4O2(g) == 1/2 P2O3 KJ/mol
网址:http://m.1010jiajiao.com/timu3_id_335481[举报]
(2009?汕头二模)不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性.一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键.下表是某些元素的电负性值:
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围
(2)请归纳元素的电负性和金属、非金属的关系是
(3)COCl2俗称光气,分子中C原子以
(4)氯和硅元素形成的化合物SiCl4为共价化合物,它与氨气一起使用可用于海上军事作战起烟幕作用,试说明原因并写出相应发生的化学反应方程式:
(5)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)是:
查看习题详情和答案>>
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围
0.93~1.57
0.93~1.57
;(2)请归纳元素的电负性和金属、非金属的关系是
非金属性越强,电负性越大,金属性越强,电负性越小
非金属性越强,电负性越大,金属性越强,电负性越小
;(3)COCl2俗称光气,分子中C原子以
sp2
sp2
杂化轨道方式与其它原子成键;分子结构中含有C-Cl键,其共用电子对偏向Cl
Cl
(写原子名称).(4)氯和硅元素形成的化合物SiCl4为共价化合物,它与氨气一起使用可用于海上军事作战起烟幕作用,试说明原因并写出相应发生的化学反应方程式:
因为四氯化硅与水发生反应(强烈水解)产生大量的氯化氢气体,氯化氢与氨气化合产生大量的白烟,起隐蔽作用;SiCl4+4H2O═4HCl↑+H4SiO4,NH3+HCl=NH4Cl
因为四氯化硅与水发生反应(强烈水解)产生大量的氯化氢气体,氯化氢与氨气化合产生大量的白烟,起隐蔽作用;SiCl4+4H2O═4HCl↑+H4SiO4,NH3+HCl=NH4Cl
;(5)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)是:
Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物
Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物
;请设计一个实验方案证明上述所得到的结论:将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物
将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物
.请你回答下列问题:
(1)攀枝花地区是我国钒钛磁铁矿的主要成矿带,钒矿资源较多,居世界第3位,钒(V)元素原子的价电子排布图为: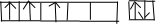
 .钛元素的基态原子的简化电子排布式
.钛元素的基态原子的简化电子排布式
(2)配合物[Cr(NH3)5SO4]Br的中心离子的符号为
(3)有下列四种无机含氧酸:①H3PO4 ②HClO3 ③H3BO3 根据无机含氧酸的酸性规律,将三种无机含氧酸按酸性强弱顺序是
(4)有下列八种物质:①CaCl2晶体 ②干冰 ③NaOH晶体 ④NH4Cl晶体⑤金刚石 ⑥金刚砂晶体.其中含有配位键的离子晶体是
(5)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为
查看习题详情和答案>>
(1)攀枝花地区是我国钒钛磁铁矿的主要成矿带,钒矿资源较多,居世界第3位,钒(V)元素原子的价电子排布图为:


[Ar]3d34s2
[Ar]3d34s2
;(2)配合物[Cr(NH3)5SO4]Br的中心离子的符号为
Cr 3+
Cr 3+
,配位数6
6
.(3)有下列四种无机含氧酸:①H3PO4 ②HClO3 ③H3BO3 根据无机含氧酸的酸性规律,将三种无机含氧酸按酸性强弱顺序是
②①③
②①③
.(4)有下列八种物质:①CaCl2晶体 ②干冰 ③NaOH晶体 ④NH4Cl晶体⑤金刚石 ⑥金刚砂晶体.其中含有配位键的离子晶体是
④
④
;属于分子晶体的是②
②
,含有非极性共价键的原子晶体是⑤
⑤
.(5)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为
δs-p
δs-p
.Cl2分子含有的共价键用符号表示为δp-p
δp-p
.已知元素的电负性与元素的化合价一样,也是元素的一种基本性质.下面给出14种元素的电负性.
根据以上的数据,可推知元素的电负性具有的变化规律是:
查看习题详情和答案>>
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2. | 1.5 | 2.5 | 2.8 | 4. | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化
在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化
.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.
(1)第三周期IA族元素的原子结构示意图是
 ,该元素与同周期VIIA族元素组成的化合物类型是
,该元素与同周期VIIA族元素组成的化合物类型是
(2)第三周期元素的最高价氧化物对应水化物中,酸性最强的是
(3)有人认为形成化合物最多的不是IVA的碳元素,而是另一种短周期元素,请你根据已学化学知识判断这一元素是
(4)由H、N、O三种元素组成的离子化合物X,在210℃时可分解生成N元素的一种气态氧化物Y和水.已知 40g X完全分解可生成11.2L(标准状况)Y,则Y的化学式为
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | H | IIA | IIIA | IVA | VA | VIA | VIIA | He |
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |


离子化合物
离子化合物
;(2)第三周期元素的最高价氧化物对应水化物中,酸性最强的是
HClO4
HClO4
(填化学式,下同);碱性最强的是NaOH
NaOH
;具有两性的是Al(OH)3
Al(OH)3
,其与氢氧化钠溶液反应的化学方程式为A1(OH)3+NaOH=NaA1O2+2H2O
A1(OH)3+NaOH=NaA1O2+2H2O
;(3)有人认为形成化合物最多的不是IVA的碳元素,而是另一种短周期元素,请你根据已学化学知识判断这一元素是
H
H
(填元素符号);(4)由H、N、O三种元素组成的离子化合物X,在210℃时可分解生成N元素的一种气态氧化物Y和水.已知 40g X完全分解可生成11.2L(标准状况)Y,则Y的化学式为
N2O
N2O
.
美国化学家鲍林(L.Pauling)首先提出了电负性的概念.电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,试回答下列问题:
(1)同主族的不同元素的电负性变化的规律是: 同周期中不同元素的电负性变化的规律是:
(2)预测周期表中,电负性最小的元素位于第 周期 族(放射性元素除外).
查看习题详情和答案>>
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
(1)同主族的不同元素的电负性变化的规律是:
(2)预测周期表中,电负性最小的元素位于第