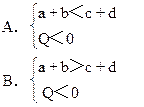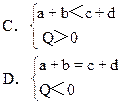摘要:13.在密闭容器中.下列反应已达平衡:aA cC+Q如果升高温度或降低压强.则C(气)的物质的量都增大.试判断下列各组关系.哪组是正确的 [ ]
网址:http://m.1010jiajiao.com/timu3_id_33501[举报]
(一)恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)?x C(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol?L-1.
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)A的转化率与B的转化率之比为
(4)下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2:1
(二)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,则正极的电极反应式为
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为
查看习题详情和答案>>
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
0.6mol/(L?min)
0.6mol/(L?min)
.(2)x=
3
3
.(3)A的转化率与B的转化率之比为
2:1
2:1
.(4)下列各项可作为该反应达到平衡状态的标志的是
B
B
.A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2:1
(二)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
<
<
0 (填“>”、“=”或“<”).②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将
A
A
.A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol
CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol
.(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,则正极的电极反应式为
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,随着反应的不断进行溶液的pH减小
减小
(填“增大”“减小”或“不变”).(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
.
| |||||||||||||||||||
 (2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示.
(2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示.(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.
NO2(g)+SO2(g)?NO(g)+SO3(g)△H=-41.8kJ?mol-1.
则反应:2NO2(g)?2NO(g)+O2(g)的△H=
+113.0
+113.0
kJ?mol-1.(2)下列描述中,一定能说明密闭容器中的反应达到平衡状态的是
BC
BC
(填字母代号).A.v(NO2)=v(NO)
B.混合气体的颜色保持不变
C.密闭容器中O2的体积分数不变
D.密闭容器中NO和O2的体积比不变
(3)实验a中,从反应开始至第一次刚达到平衡时段,生成O2的平均速率为
0.017
0.017
mol/(L?min)(答案保留两位有效数字).(4)由图象信息推断,T1℃
低于
低于
T2℃(填“低于”或“高于”),理由是T2℃时反应到达平衡所用时间短,说明速率快,所以温度高
T2℃时反应到达平衡所用时间短,说明速率快,所以温度高
.(5)20-25min时间段,a曲线变化的可能原因是
A
A
(填字母代号,下同),30-35min时间段.a曲线变化的可能原因是.B
B
.A.升高温度 B.缩小容器体积 C.降低温度 D.扩大容器体积 E.在恒容条件下充入NO2
(6)若在实验b初始,向该2L密闭容器中通入的是1molNO2、1molNO、0.5molO2,则达到平衡后NO2的浓度是.
0.2mol/L
0.2mol/L
,NO2的转化率为60%
60%
.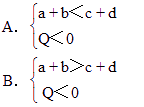
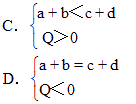
 cC(气)+dD(气)+Q如果升高温度或降低压强,则C(气)的物质的量都增大,试判断下列各组关系,哪组是正确的
cC(气)+dD(气)+Q如果升高温度或降低压强,则C(气)的物质的量都增大,试判断下列各组关系,哪组是正确的