网址:http://m.1010jiajiao.com/timu3_id_334003[举报]
 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:(1)将E的单质投入水中,发生反应的离子方程式为
(2)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(3)化学反应3A2(g)+C2(g)?2CA3(g).△H=-92.4kJ?mol-1
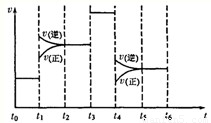
①当反应达到平衡时不断改变条件(不改变A2、C2和CA3的 量),如图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
②温度为T℃时,将5mol A2和2mol C2放入0.5L密闭容器中,平衡后测得C2的转化率为50%,计算反应的平衡常数为
(4)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量.1mol液态水变为水蒸气需吸收44.0kJ的热量.写出液态C2 A4与液态双氧水反应,生成C2和水蒸气的热化学方程式
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(2)元素Z与元素T相比,非金属性较强的是
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4.4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
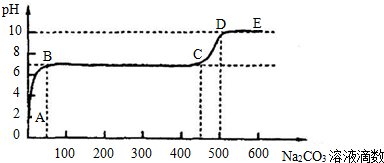
请用离子方程式表示BC段、CD段发生的反应:
BC段:
CD段:
X、Y、Z、T、W五种元素的性质或原子结构如下表:
|
元素 |
元素性质或原子结构 |
|
X |
原子的最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
|
Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
|
T |
与Z同周期,元素最高价是+7价 |
|
W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化 曲线如下图所示:

请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
查看习题详情和答案>>
X、Y、Z、T、W五种元素的性质或原子结构如下表:
|
元素 |
元素性质或原子结构 |
|
X |
原子的最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
|
T |
与Z同周期,元素最高价是+7价 |
|
W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______;W元素基态原子电子排布式
为______________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________________。
A.常温下Z的单质和T的单质状态不同
B. T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D. T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为______,它所形成的晶体类型为______; Y的常见氢化物易液化的主要原因是________________________。
(4)元素X与钙元素可以形成一种离子化合物,该化合物的阴离子和CO互为等电子体,该化合物的电子式为 ;其中元素X的杂化类型是 。
查看习题详情和答案>>
(1)将E的单质投入水中,发生反应的离子方程式为______该反应的氧化剂是______.
(2)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是______.
(3)化学反应3A2(g)+C2(g)?2CA3(g).△H=-92.4kJ?mol-1
①当反应达到平衡时不断改变条件(不改变A2、C2和CA3的 量),如图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是______.
②温度为T℃时,将5mol A2和2mol C2放入0.5L密闭容器中,平衡后测得C2的转化率为50%,计算反应的平衡常数为______.
(4)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量.1mol液态水变为水蒸气需吸收44.0kJ的热量.写出液态C2 A4与液态双氧水反应,生成C2和水蒸气的热化学方程式______.
 查看习题详情和答案>>
查看习题详情和答案>>