网址:http://m.1010jiajiao.com/timu3_id_332561[举报]
![]()
其中反应②为:4NO+3O2+2H2O====4HNO3,原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
(1)写出反应①的化学方程式____________________________________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中制备硝酸的氨气(不包含第③步被硝酸吸收的氨气)的体积分数最大值为__________。
(3)若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为多少?在合成硝酸铵的全流程中,氨气的总利用率为多少?(请写出该小题的计算过程)
查看习题详情和答案>>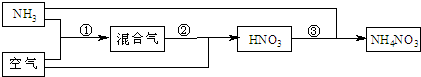
其中反应①为4NH3+5O2
| ||
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:

其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
⑴步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________
________________________。
⑵若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
⑶假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
查看习题详情和答案>>某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:

其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨
(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
查看习题详情和答案>>某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:

其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示_______
_____________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
查看习题详情和答案>>