摘要:25. 目前加碘食盐的添加剂是碘酸钾.碘酸钾是一种白色结晶粉末.无臭无味.酸性条件下碘酸钾是一种较强的氧化剂.与氢碘酸.二氧化硫等还原性物质作用.被还原为单质碘.在碱性介质中.碘酸钾能被氯气.次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定.加热至560℃开始分解.工业生产碘酸钾的流程如下.在反应器中发生的反应方程式为:6I2 +11KClO3 +3H2O =6KH(IO3)2 +5KCl +3Cl2↑.试回答下列问题: (1)对反应产物酸化时.用硝酸而不用HI.其原因可能是 (2)要保持溶液微沸1小时.以完全排出氯气.检验氯气已完全排出简单实验方法是 . (3)合成实验中涉及两次过滤.在实验室进行过滤实验时.用到的玻璃仪器有 . (4)在过滤器上洗涤沉淀的操作是:向漏斗里注入 . (5)参照碘酸钾与氢氧化钾溶解度曲线.操作a得到碘酸钾晶体.你建议的方法是 温度 0 10 20 40 60 80 KIO3g/100g水 4.60 6.27 8.08 12.6 18.3 24.8 KOHg/100g水 49.2 50.8 52.8 59.8 62.4 78.6
网址:http://m.1010jiajiao.com/timu3_id_33228[举报]
目前加碘食盐的添加剂是碘酸钾,碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生的反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.试回答下列问题:
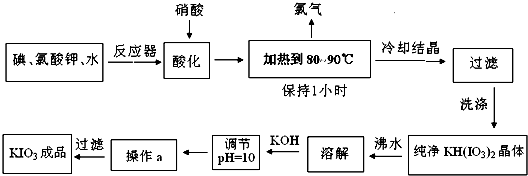
(1)对反应产物酸化时,用硝酸而不用HI,其原因可能是
(2)要保持溶液微沸(加热到80~90℃)1小时,以完全排出氯气.检验氯气完全排出简单实验方法是 .
(3)合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有 .
(4)在过滤器上洗涤沉淀的操作是: .
(5)参照碘酸钾与氢氧化钾溶解度表格,操作a得到碘酸钾晶体,你建议的方法是
查看习题详情和答案>>

(1)对反应产物酸化时,用硝酸而不用HI,其原因可能是
(2)要保持溶液微沸(加热到80~90℃)1小时,以完全排出氯气.检验氯气完全排出简单实验方法是
(3)合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有
(4)在过滤器上洗涤沉淀的操作是:
(5)参照碘酸钾与氢氧化钾溶解度表格,操作a得到碘酸钾晶体,你建议的方法是
| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KOH g/100g水 | 49.2 | 50.8 | 52.8 | 59.8 | 62.4 | 78.6 |
 (2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
(2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.几种盐的溶解度(g/100g水)
| 温 度/℃ 物质 |
0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| CaCl2 | 59.5 | 64.7 | 74.5 | 128 | 137 | 147 |
| Ca(IO3)2 | 0.119(5℃) | 0.195(15℃) | 0.307(25℃) | 0.520 | 0.621 | 0.669 |
步骤1:在100mL圆底烧瓶中依次加入2.20g 碘、2.00g 氯酸钾和45mL水,加热、搅拌,使氯酸钾溶解.
步骤2:滴加6mol/L盐酸至pH=1,按如图所示组装仪器,保持水浴温度85℃左右,发生反应:
I2+2KClO3+HCl═KIO3+HIO3+KCl+Cl2↑
步骤3:将反应液转入150mL 烧杯中,加入A溶液,调节溶液pH=10.
步骤4:用滴定管加10mL 1mol/L CaCl2溶液,并不断搅拌.
步骤5:反应混合物先用水冷却,再在冰水中静置10分钟,过滤,用少量冰水洗三次,再用少量无水乙醇洗涤一次,抽干后,将产品转移到滤纸上,晾数分钟,得碘酸钙产品.
①步骤2中反应温度不能太高的原因是
温度过高,碘升华,KIO3分解,影响产率
温度过高,碘升华,KIO3分解,影响产率
.②步骤3中A溶液是
KOH溶液或Ca(OH)2 溶液
KOH溶液或Ca(OH)2 溶液
.③步骤4中实验现象是
出现浑浊
出现浑浊
有沉淀生成
有沉淀生成
.④步骤5中在冰水中冷却静置的目的是
使Ca(IO3)2沉淀完全
使Ca(IO3)2沉淀完全
.再用无水乙醇洗涤的目的是乙醇易挥发可加快干燥
乙醇易挥发可加快干燥
.(2)测定产品中碘酸钙含量的实验步骤如下:
准确称取产品a g(约0.6g),置于100mL烧杯中,加1:1高氯酸20mL,微热溶解试样,冷却后移入250mL 容量瓶中,用水稀释至刻度,摇匀,得试液.
准确量取所得试液50.00mL 置于250mL 碘量瓶中,加入1:1高氯酸2mL,3g 碘化钾,盖上瓶塞,在暗处放置3 分钟,加50mL 水,用浓度为0.1000mol/L Na2S2O3标准溶液滴定至浅黄色,加入 2mL 0.5%淀粉溶液,继续滴定至终点,读数.
滴定过程中发生的反应如下:
Ca(IO3)2+2HClO4═2HIO3+Ca(ClO4)2,IO3-+5I-+6H+═3I2+3H2O,I2+2S2O32-═2I-+S4O62-
①准确量取50.00mL试液的玻璃仪器是
酸式滴定管或移液管
酸式滴定管或移液管
.②滴定至终点的现象是
溶液蓝色消失,且半分钟内不恢复
溶液蓝色消失,且半分钟内不恢复
.③为准确获得样品中Ca(IO3)2的含量,还需补充的实验是
重复测定两次
重复测定两次
.