摘要:0.25mol/L H2SO4溶液10mL与0.5mol/L NaOH溶液10mL混合后.在加水稀释为100mL.各取少量分别加入有关指示剂.呈现颜色正确的是: (1)甲基橙��黄色,(2)酚酞��红色, (3)石蕊��红色,(4)酚酞��无色, A. C.
网址:http://m.1010jiajiao.com/timu3_id_332004[举报]
在一定温度下,向一容积为2L升的恒容密闭容器内加入0.2mol的N2和0.6mol的H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:
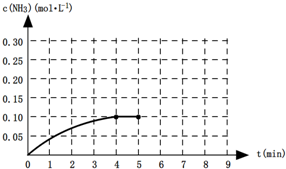
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)= .
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (选填字母编号).
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为 .反应达到平衡后,第5分钟时,若保持其它条件不变,只把容器的体积缩小一半,平衡 移动(选填“正向”、“逆向”或“不”),化学平衡常数K (选填“增大”、“减小”或“不变”).
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象 ,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33).
查看习题详情和答案>>

(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象
(2008?天津)(1)配平氧化还原反应方程式:
+
+
(2)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.
①第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H+的物质的量为
②第二份溶液滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色,由
③原试样中H2C2O4?2H2O的质量分数为
查看习题详情和答案>>
5
5
C2O2- 4 |
2
2
MnO- 4 |
16
16
H+═10
10
CO2↑+2
2
Mn2++8
8
H2O(2)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.
①第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H+的物质的量为
0.005
0.005
mol.②第二份溶液滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色,由
无色
无色
变为紫红色
紫红色
.该溶液中还原剂的物质的量0.004
0.004
mol.③原试样中H2C2O4?2H2O的质量分数为
21%
21%
,KHC2O4的质量分数为64%
64%
.