摘要:铅蓄电池反应如下: 对铅蓄电池工作情况.下列叙述错误的是( ) A.放电时Pb极为负极 B.充电时蓄电池上标有“+ 号电极连接电源正极 C.放电时正极反应为PbO2+ SO42- +4H++2e ==PbSO4+2H2O D.充电时蓄电池上标有“- 号的电极发生氧化反应
网址:http://m.1010jiajiao.com/timu3_id_331835[举报]
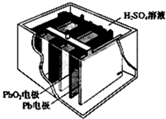 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A、PbO2是电池的负极 | B、放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 | C、放电时,电子由Pb 极通过导线流向 PbO2 | D、正极的电极反应式为Pb-2e-=Pb2+ |
实验室用铅蓄电池进行电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极为Pb+S
?PbSO4+2e-,
正极为PbO2+4H++S
+2e-?PbSO4+2H2O,
今若制得Cl2 0.025mol,这时电池内消耗的H2SO4的物质的量至少是( )
负极为Pb+S
| O | 2- 4 |
正极为PbO2+4H++S
| O | 2- 4 |
今若制得Cl2 0.025mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A、0.025 mol |
| B、0.050 mol |
| C、0.10 mol |
| D、0.20 mol |