摘要:颜色无变化 KSCN溶液 试液 溶液变为血红色. H2O2溶液 19.下列根据实验事实得出的结论.正确的有 . ① 稀HNO3 结论:试液中含有Fe2+ BaCl2溶液 试液 沉淀不溶解. 白色沉淀 ② 新制Cu(OH)2 煮沸 稀硫酸 Δ 结论:试液中含有SO42- 无红色沉淀. 淀粉溶液 颜色无变化 ③ 逐滴加入稀硫酸 结论:淀粉未水解 溶液的导电能力先减弱后增强 Ba(OH)2溶液 ④ CuSO4溶液 纯锌片 结论:Ba(OH)2和H2SO4之间的反应是离子反应 产生大量气泡. 产生少量气泡 稀硫酸 ⑤ 结论:CuSO4是锌与稀硫酸反应的催化剂 (2)现有三位同学分别利用浓盐酸.MnO2共热制Cl2.并用Cl2和Ca(OH)2反应制取少量漂白粉.设计了三套实验装置: A B C D E F G 甲 乙 丙 已知:温度稍高即发生如下副反应:6Cl2+6 Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O (Ⅰ)请从:①不容易控制反应速率.②容易控制反应速率.③有副反应发生.④可防止副反应发生.⑤污染环境.⑥可防止污染环境几个方面对上述甲.乙.丙三套装置的优缺点作出评价.并选择符合题目要求的选项填在空格内. 优点 缺点 甲装置 乙装置 丙装置 (Ⅱ)请从上述装置的A-G的组成中选取合理的部分组装一套较完善的实验装置.装置各部分的连接顺序是 . 20.为了测定空气中CO2的含量.可按如下步骤进行实验: ①分别配制100mL0.1mol·L-1和100mL0.01mol·L-1的标准盐酸, ②用0.1mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10mL.用去标准盐酸19.6mL, ③另取上述Ba(OH)2溶液10mL放入100mL的容量瓶中.加蒸馏水稀释至刻度.把稀释后溶液放入密闭容器中并导入10L空气.充分振荡后过滤, ④取上述滤液20mL.用0.01mol·L-1的盐酸滴定.用去盐酸34.8mL. 根据上述实验回答下列问题: (1)配制上述标准盐酸时.所需的玻璃仪器有:移液管(用于准确量取所需较浓盐酸的体积).烧杯. , (2)写出第③步的密闭容器中所发生反应的离子方程式: , (3)滴定过程中左手绝对不能离开活塞.右手拿住锥形瓶瓶颈并 ,眼睛应始终注视 . (4)若第②步滴定时使用过的酸式滴定管未经处理.立即更换溶液进行第④步滴定.会使实验结果 (填“偏高 .“偏低 或“无影响 ), (5)根据实验数据可以计算出空气中CO2的体积百分含量是 .
网址:http://m.1010jiajiao.com/timu3_id_331524[举报]
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
(1)若只有Fe2O3,则实验现象是
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物.实验小组欲测定Cu2O的质量分数.已知Cu2O在空气中加热生成CuO.
测定流程:

实验中操作A的名称为
灼烧过程中,所需仪器有:酒精灯、玻璃棒、
(4)写出混合物中Cu2O的质量分数的表达式
(或
%)
(或
%).
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案制取胆矾:
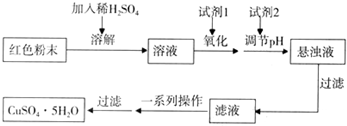
(5)用试剂编号表示:试剂l为
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?
查看习题详情和答案>>
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
(1)若只有Fe2O3,则实验现象是
固体完全溶解,溶液呈血红色
固体完全溶解,溶液呈血红色
.(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
Fe2O3+6H+═2Fe3++3H2O Cu2O+2H+═Cu+Cu2++H2O2Fe3++Cu═2Fe2++Cu2+
Fe2O3+6H+═2Fe3++3H2O Cu2O+2H+═Cu+Cu2++H2O2Fe3++Cu═2Fe2++Cu2+
.(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物.实验小组欲测定Cu2O的质量分数.已知Cu2O在空气中加热生成CuO.
测定流程:

实验中操作A的名称为
恒重操作
恒重操作
.灼烧过程中,所需仪器有:酒精灯、玻璃棒、
坩埚
坩埚
等(夹持仪器除外).(4)写出混合物中Cu2O的质量分数的表达式
| 9(b-a) |
| a |
| 900(b-a) |
| a |
| 9(b-a) |
| a |
| 900(b-a) |
| a |
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案制取胆矾:

(5)用试剂编号表示:试剂l为
B
B
,试剂2为D
D
.(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?
由于亚铁离子和铜离子开始沉淀、沉淀完全的pH值很接近,难以分离,把亚铁离子氧化为铁离子,pH控制范围:3.7<pH<6将铁离子转化为沉淀而被除去
由于亚铁离子和铜离子开始沉淀、沉淀完全的pH值很接近,难以分离,把亚铁离子氧化为铁离子,pH控制范围:3.7<pH<6将铁离子转化为沉淀而被除去
.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
×100%
×100%.
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
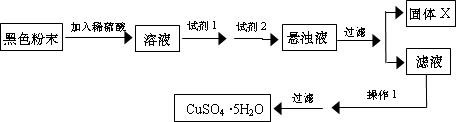
试回答:
①试剂I为
②固体X的化学式为
③操作I为
查看习题详情和答案>>
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
溶液变为血红色
溶液变为血红色
.(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
简述你的理由(不需写出反应的方程式 )Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
.探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
①试剂I为
B
B
,试剂II为D
D
(填字母).②固体X的化学式为
Fe(OH)3
Fe(OH)3
.③操作I为
加热蒸发
加热蒸发
.三草酸合铁酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.某化学兴趣小组将无水三草酸合铁酸钾按如图所示装置进行实验:请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.

限选试剂:浓硫酸、1.0mol/LHNO3、1.0mol/L盐酸、1.0mol/LNaOH、3% H2O2、0.1mol/LKI、0,1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)若实验中,观察到B、F中溶液均变浑浊,则E中的现象是
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是
(3)固体产物中铁元素存在形式的探究.
提出合理假设:假设1:
设计实验方案证明你的假设(不要在答题卷上作答)
实验过程
根据上述实验方案进行实验.在答题卷上填写实验步骤、预期现象与结论中的空格.
查看习题详情和答案>>

限选试剂:浓硫酸、1.0mol/LHNO3、1.0mol/L盐酸、1.0mol/LNaOH、3% H2O2、0.1mol/LKI、0,1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)若实验中,观察到B、F中溶液均变浑浊,则E中的现象是
粉末由黑色变为红色
粉末由黑色变为红色
,推测三草酸合铁酸钾分解的气体产物是CO和CO2
CO和CO2
.(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是
利用焰色反应
利用焰色反应
,现象是透过蓝色钴玻璃观察到紫色火焰
透过蓝色钴玻璃观察到紫色火焰
.(3)固体产物中铁元素存在形式的探究.
提出合理假设:假设1:
全部为铁单质
全部为铁单质
;假设2:全部为FeO
全部为FeO
;假设3:同时存在铁单质和FeO
同时存在铁单质和FeO
.设计实验方案证明你的假设(不要在答题卷上作答)
实验过程
根据上述实验方案进行实验.在答题卷上填写实验步骤、预期现象与结论中的空格.
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解.分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体. | 固体产物部分溶解. |
| 步骤2:向试管中加入适量 CuSO4 CuSO4 溶液,再加入少量不溶固体,充分振荡. |
(1)若溶液颜色及加入的不溶固体无明显变化,则假设 2 2 成立.(2)若溶液颜色明显改变,且有 暗红 暗红 色固体生成,则证明有铁单质 铁单质 存在 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量 HCl HCl ,静置,取上层清液,滴加适量KSCN KSCN ,充分振荡后滴加H2O2 H2O2 . |
结合步骤2中的(2): (1)若溶液基本无色,则假设 1 1 成立(2)若溶液呈血红色,则假设 3 3 成立 |