摘要:14.有A1和A2两种元素.已知A2原子中L层电子数是M层电子数的.而A1原子中M层电子数是A2原子M层电子数的.则A1与A2分别是( ) A.Cl.F B.Fe.Cl C.Br.Al D.Al.Br
网址:http://m.1010jiajiao.com/timu3_id_330190[举报]
已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数. 其中B1的沸点比B2高.
试回答下列问题:
(1)上述两组八种微粒的组成元素中,原子序数处在中间的元素在元素周期表的位置是 ; D2的电子式为: .
(2)写出B1转化为A1、C1的方程式: ;液态的B2与Na反应的方程式: .
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备方程式 ,其中D1的作用是 ;
②利用①中原理制备出NaClO2?3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下(已知:I2+2S2O32ˉ=S4O62ˉ+2Iˉ):
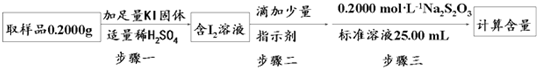
步骤一的离子方程式为 ;步骤二的指示剂是 ;步骤三中出现 现象时,达到滴定终点;计算该试样中NaClO2?3H2O的质量百分数为 .
查看习题详情和答案>>
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)上述两组八种微粒的组成元素中,原子序数处在中间的元素在元素周期表的位置是
(2)写出B1转化为A1、C1的方程式:
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备方程式
②利用①中原理制备出NaClO2?3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下(已知:I2+2S2O32ˉ=S4O62ˉ+2Iˉ):

步骤一的离子方程式为
有原子序数依次增大的四种短周期元素A、B、C、D.已知:
①A元素有三种同位素A1、A2、A3.其中自然界里最多的一种同位素A1的质量数分别是A2的1/2、A3的1/3.
②常温下,B元素的气态氢化物的水溶液pH>7.
③C元素的质子数等于A元素与B元素两者的质子数之和.
④金属元素D的原子核内质子数比上一周期同主族元素多8个,且单质D不能从硫酸铜溶液中置换出铜.
请回答下列问题:
(1)C元素在周期表中的位置是________.
(2)比较B、C、D相应的简单离子的半径,由大到小的顺序为________.
(3)请写出单质D与硫酸铜溶液反应的化学方程式________.
(4)A、B两种元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1∶5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构.写出A的电子式________.A物质与水反应生成一种碱和无色气体,写出有关的化学方程式________.