摘要:在常温常压下.100毫升H2S与O2的混和气体在一定条件下完全反应.恢复到原状态时.最后得到气体25毫升.试求最后得到的气体是什么?原混和气体中两种气体各占多少毫升? [提示]:当硫化氢过量时.硫化氢与氧气的体积分别是75毫升和25毫升,当最后得到的气体是二氧化硫时.两种气体的体积都是50毫升(此时可用直接配平法求出)
网址:http://m.1010jiajiao.com/timu3_id_328574[举报]
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2①在以上制备甲醇的两个反应中:反应I优于反应II,原因为
反应I符合“原子经济性”的原则即原子利用率为100%
反应I符合“原子经济性”的原则即原子利用率为100%
.②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
逆向
逆向
移动(填“正向”、“逆向”、“不”).II、某温度下,将1mol CO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为
80%
80%
,此时的温度<
<
250℃(填“>”、“<”、“=”)(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-Q2 kJ/mol③H2O(g)=H2O(l)△H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:
CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=(2Q3+0.5Q2-0.5Q1)kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=(2Q3+0.5Q2-0.5Q1)kJ/mol
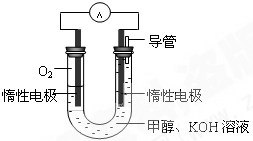
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将
降低
降低
填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.(15分)运用化学反应原理研究常见元素的单质及其化合物有重要意义。
(1)合成氨反应N2 (g)+3H2(g)
 2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
(2)向Na2C2O4溶液加入少量石蕊,溶液显 色,请用离子方程式表示出现该现象的原因: ;
(3)pH相同的氨水和氢氧化钠,分别用蒸馏水稀释至原来溶液的100倍,则稀释后两种溶液的pH分别为m和n,则m n(选填“>”“<”“=”);
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃料电池。请写出该电池的正极反应式 。
(5)氢气燃烧热值高。实验测得,在常温常压下,4gH2完全燃烧生成液态水,放出571.6kJ热量,则表示H2燃烧热的热化学方程式为 。
(6)某温度(t℃)时,测得0.01mol・L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va∶Vb= 。
查看习题详情和答案>>