摘要:9.(1)①CO2 ②Cu ③O2 ④H2O (2)铜绿或碱式碳酸铜
网址:http://m.1010jiajiao.com/timu3_id_328049[举报]
以下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体.
请回答下列问题:

(1)C的电子式为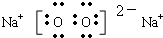
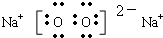 ,C物质中所含化学键类型
,C物质中所含化学键类型
(2)反应①的离子方程式是:
(3)写出B与G溶液反应的离子方程式
(4)在I溶液中通入过量CO2反应的化学方程式
查看习题详情和答案>>
请回答下列问题:

(1)C的电子式为
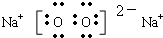
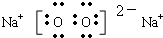
离子键、非极性共价键
离子键、非极性共价键
.(2)反应①的离子方程式是:
2Al+2H2O+2OH-=2AlO2-+3H2↑.
2Al+2H2O+2OH-=2AlO2-+3H2↑.
.(3)写出B与G溶液反应的离子方程式
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(4)在I溶液中通入过量CO2反应的化学方程式
2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓
2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓
.(2012?韶关一模)根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)H2(g)+
O2(g)=2H2O(l)△H2=-285.8kJ/mol
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)H2(g)+
| 1 |
| 2 |
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
查看习题详情和答案>>
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g);△H=+131.3kJ?mol-1,
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
bc
bc
(填字母序号).a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
试回答下列问题:
①若起始时c(CO)=2mol?L-1,c(H2O)=3mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
1
1
.②在相同温度下,若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.5mol?L-1,则此时该反应v(正)
大于
大于
v(逆)(填“大于”“小于”或“等于”)③若降低温度,该反应的K值将
增大
增大
(填“增大”“减小”或“不变”).(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
cd
cd
.a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
 9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)根据题意完成下列各题:
(1)在某温度下,反应物的起始浓度分别为:
c(CO)=1mol,L-1,c(H2)=2mol?L-1; 达到平衡后,H2的转化率为60%,平衡常数K=
2.34
2.34
,升高温度,K值减小
减小
(填“增大”、“减小”或“不变”).(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
bc
bc
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
Cu2O+CO 2Cu+CO2
2Cu+CO2
 2Cu+CO2
2Cu+CO2Cu2O+CO 2Cu+CO2
2Cu+CO2
(用化学方程式表示). 2Cu+CO2
2Cu+CO2 (4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是
(4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是AD
AD
.A.10~15min可能是加入了正催化剂
B.10~15min可能是降低了温度
C.20min时可能是缩小了容器体积
D.20min时可能是增加了B的量.