摘要: 步骤1中集气瓶中有少量气泡不扣分.
网址:http://m.1010jiajiao.com/timu3_id_32787[举报]
下面是关于硫化氢的部分文献资料:

某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
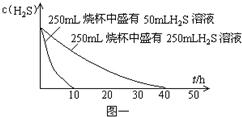
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象.用相同浓度的碘水测氢硫酸溶液浓度.图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况.
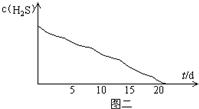
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水测定,图二所示为氢硫酸浓度随放置天数变化的情况.
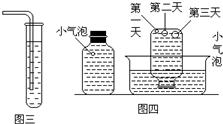
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气,数小时未见变浑浊,如图三.
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊.当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊也更明显些,如图四.
请回答下列问题:(1)实验一中,氢硫酸的浓度随时间变化而减小的主要因素是
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为H2S+I2=2HI+S,其基本反应类型为
(3)实验三的设计意图是
此实验中通入空气的速度很慢的主要原因是什么?
(4)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是
查看习题详情和答案>>

某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象.用相同浓度的碘水测氢硫酸溶液浓度.图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况.

实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水测定,图二所示为氢硫酸浓度随放置天数变化的情况.

实验三:在饱和氢硫酸溶液中以极慢的速度通入空气,数小时未见变浑浊,如图三.
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊.当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊也更明显些,如图四.
请回答下列问题:(1)实验一中,氢硫酸的浓度随时间变化而减小的主要因素是
H2S的挥发
H2S的挥发
.(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为H2S+I2=2HI+S,其基本反应类型为
置换反应
置换反应
.(3)实验三的设计意图是
检验氢硫酸长期存放变浑浊的原因是否为“氢硫酸和空气中的氧气反应生成硫”
检验氢硫酸长期存放变浑浊的原因是否为“氢硫酸和空气中的氧气反应生成硫”
.此实验中通入空气的速度很慢的主要原因是什么?
防止因通入空气过快而使H2S大量挥发
防止因通入空气过快而使H2S大量挥发
.(4)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是
H2S=H2↑+S
H2S=H2↑+S
(用反应式表示).为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字简单说明实验设想,不需要回答实际步骤和设计实验方案)?通过实验验证生成的气体是氢气
通过实验验证生成的气体是氢气
.
(2012?盐城模拟)今天是实验室开放日,小明、小军、小红一起到化学实验室进行科学探究活动,他们看到实验台上有两瓶没有标签的无色溶液,老师告诉他们,其中一瓶是稀盐酸,另一瓶是石灰水,他们决定用不同的方案对这两种溶液进行鉴别: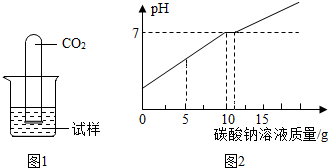
【设计实验】
小明准备用无色酚酞溶液;
小红提议可用碳酸钠溶液来鉴别;
小军想分别将一支盛有二氧化碳气体的试管,分别倒扣在盛有这两种溶液的烧杯中,如图1所示.
【进行实验】
(1)小明、小红分别将这两种溶液分别各取2mL,装在两支试管中,他们将试管依次编号为①~④号,小军取这两种溶液各30mL,分别倒入两个小烧杯中,再在编号为⑤、⑥号的两支集满二氧化碳的气体;
(2)各自按自己的思路进行了实验,现象如下:试管①中液体由无色变为红色,试管③中液体变浑浊,试管⑥中液面上升.
(3)三位同学在实验后,将试管中的物质倒入同一个废液缸中,发现废液为无色透明.
【分析与计算】
(1)试管①中所盛的液体为
(2)试管④中发生反应的化学方程式为
(3)试管⑥还能观察到的现象是
(4)废液缸中除了酚酞、水以外,一定存在的物质有
为避免污染环境,化学兴趣小组对该废液的成分进行了如下实验:
取出废液缸中废液共14.6g,向其中加入适量的水,向溶质质量分数为2.12%的碳酸钠溶液.所得溶液的pH与加入的碳酸钠溶液的质量关系如图2所示:
Ⅰ、通过图2可知,当碳酸钠溶液质量加到10g时,废液中溶质为
Ⅱ、原废液中氯化氢的质量分数?
查看习题详情和答案>>

【设计实验】
小明准备用无色酚酞溶液;
小红提议可用碳酸钠溶液来鉴别;
小军想分别将一支盛有二氧化碳气体的试管,分别倒扣在盛有这两种溶液的烧杯中,如图1所示.
【进行实验】
(1)小明、小红分别将这两种溶液分别各取2mL,装在两支试管中,他们将试管依次编号为①~④号,小军取这两种溶液各30mL,分别倒入两个小烧杯中,再在编号为⑤、⑥号的两支集满二氧化碳的气体;
(2)各自按自己的思路进行了实验,现象如下:试管①中液体由无色变为红色,试管③中液体变浑浊,试管⑥中液面上升.
(3)三位同学在实验后,将试管中的物质倒入同一个废液缸中,发现废液为无色透明.
【分析与计算】
(1)试管①中所盛的液体为
石灰水
石灰水
.(2)试管④中发生反应的化学方程式为
Na2CO3+2HCl=2NaCl+CO2↑+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
.(3)试管⑥还能观察到的现象是
无色液体变浑浊
无色液体变浑浊
.(4)废液缸中除了酚酞、水以外,一定存在的物质有
CaCl2、NaCl
CaCl2、NaCl
,(填化学式)为进一步确定该废液是否存在盐酸,小红又设计并完成如下实验:| 实验步骤 | 实验现象 | 结论 |
| 取少量该溶液,向其中加入 少量碳酸钠 少量碳酸钠 |
有气泡生成 有气泡生成 |
废液中存在盐酸 |
取出废液缸中废液共14.6g,向其中加入适量的水,向溶质质量分数为2.12%的碳酸钠溶液.所得溶液的pH与加入的碳酸钠溶液的质量关系如图2所示:
Ⅰ、通过图2可知,当碳酸钠溶液质量加到10g时,废液中溶质为
CaCl2、NaCl
CaCl2、NaCl
(填化学式).Ⅱ、原废液中氯化氢的质量分数?