摘要:氮分子的电子式是 .在氮分子中NN的键能很大.而氮气的熔.沸点很低.其原因是 . 答案:.N2的熔.沸点与氮分子间的作用力有关.与NN的键能无关.因氮分子间的作用力很弱.所以其熔.沸点较低催化剂
网址:http://m.1010jiajiao.com/timu3_id_326761[举报]
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质。
(1)写出N2H62+在碱性溶液中反应的离子方程式___________ 。
(2)NH2-的电子式为______________ 。
(3)N3-有 ________个电子。
(4)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式____ 。
(5)等电子数的微粒往往具有相似的结构,试预测N3-的构型___________ 。
(6)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个NN键。则“N5”分子碎片所带电荷是_____________ 。
查看习题详情和答案>>
(1)写出N2H62+在碱性溶液中反应的离子方程式___________ 。
(2)NH2-的电子式为______________ 。
(3)N3-有 ________个电子。
(4)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式____ 。
(5)等电子数的微粒往往具有相似的结构,试预测N3-的构型___________ 。
(6)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个NN键。则“N5”分子碎片所带电荷是_____________ 。
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:

请回答下列问题:
(1)由B2O3制备BN的化学方程式是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的键角是
(4)BF3和过量NaF作用可生成NaBF4,
的立体构型为
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
查看习题详情和答案>>

请回答下列问题:
(1)由B2O3制备BN的化学方程式是
B2O3+2NH3
2BN+3H2O
| ||
B2O3+2NH3
2BN+3H2O
;
| ||
(2)基态B原子的电子排布式为
1s22s22p1
1s22s22p1
;B和N相比,电负性较大的是N
N
;BN中B元素的化合价为+3价
+3价
;(3)在BF3分子中,F-B-F的键角是
120°
120°
,B原子的杂化轨道类型为sp2杂化
sp2杂化
,(4)BF3和过量NaF作用可生成NaBF4,
| BF | - 4 |
正四面体
正四面体
;(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
共价键
共价键
,层间作用力为范德华力
范德华力
.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________,该晶体的配位体为__________。
(3)已知:
(1)砷原子核外电子排布式为________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________,该晶体的配位体为__________。
(3)已知:

分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因____________。
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_____________。
③综合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时__________先液化。
(4)CO的结构可表示为C O,N2的结构可表示为N
O,N2的结构可表示为N N。下表是两者的键能数据:(单位:kJ/mol)
N。下表是两者的键能数据:(单位:kJ/mol)
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因____________。
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_____________。
③综合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时__________先液化。
(4)CO的结构可表示为C
 O,N2的结构可表示为N
O,N2的结构可表示为N N。下表是两者的键能数据:(单位:kJ/mol)
N。下表是两者的键能数据:(单位:kJ/mol) 
结合数据说明CO比N2活泼的原因:__________________________________。
查看习题详情和答案>>
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质.
(1)写出N2H62+在碱性溶液中反应的离子方程式:________.
(2)NH2-的电子式为________.
(3)N3-有________个电子.
(4)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式________.
(5)等电子数的微粒往往具有相似的结构,试预测N3-的构型________.
(6)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N![]() N键.则“N5”的分子碎片所带的电荷是________.
N键.则“N5”的分子碎片所带的电荷是________.
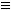 N键。则“N5”分子碎片所带电荷是____。
N键。则“N5”分子碎片所带电荷是____。