摘要:9.对于温度与反应方向的关系.下列判断一定不正确的是 A. △H<0 .△S>0.所有温度下反应自发进行 B. △H<0 .△S<0.低温下反应自发进行 C. △H>0 .△S>0.所有温度下反应自发进行 D. △H>0 .△S<0.所有温度下反应不能自发进行
网址:http://m.1010jiajiao.com/timu3_id_324346[举报]
对于温度与反应方向的关系,下列判断一定不正确的是
A. △H<0 ,△S>0,所有温度下反应自发进行
B. △H<0 ,△S<0,低温下反应自发进行
C. △H>0 ,△S>0,所有温度下反应自发进行
D. △H>0 ,△S<0,所有温度下反应不能自发进行
查看习题详情和答案>>|
对于温度与反应方向的关系,下列判断一定不正确的是 | |
| [ ] | |
A. |
ΔH<0,ΔS>0,所有温度下反应自发进行 |
B. |
ΔH<0,ΔS<0,低温下反应自发进行 |
C. |
ΔH>0,ΔS>0,所有温度下反应自发进行 |
D. |
ΔH>0,ΔS<0,所有温度下反应不能自发进行 |
在体积可变的密闭容器中,对于可逆反应A+3B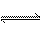 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断不正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断不正确的是
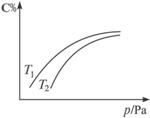
A.若正反应方向ΔH>0,则T1>T2
B.若压缩体积,混合气体的平均相对分子质量增大
C.B不一定为气体
D.A可能为气体
查看习题详情和答案>>在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如下表,完成下列问题.
(1)该反应的化学平衡常数表达式为K=______;K1______ K2(填“>”“<”或“=”);若增大压强使平衡向正反应方向移动,则平衡常数______(填“变”或“不变”).
(2)判断该反应达到化学平衡状态的依据是______(填序号):
A.2VH2(正)=3VNH3(逆)
B.N2的消耗速率等于H2的消耗速率
C. 溶器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
实验1中以v(NH3)表示的反应速率为______,实验2的速率比实验1快的原因是______;
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图).则其正极的电极反应为______.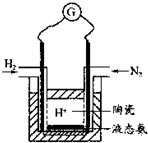
查看习题详情和答案>>
其化学平衡常数K与温度t的关系如下表,完成下列问题.
| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
(2)判断该反应达到化学平衡状态的依据是______(填序号):
A.2VH2(正)=3VNH3(逆)
B.N2的消耗速率等于H2的消耗速率
C. 溶器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图).则其正极的电极反应为______.

在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如下表,完成下列问题.
(1)该反应的化学平衡常数表达式为K=______;K1______ K2(填“>”“<”或“=”);若增大压强使平衡向正反应方向移动,则平衡常数______(填“变”或“不变”).
(2)判断该反应达到化学平衡状态的依据是______(填序号):
A.2VH2(正)=3VNH3(逆)
B.N2的消耗速率等于H2的消耗速率
C. 溶器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
实验1中以v(NH3)表示的反应速率为______,实验2的速率比实验1快的原因是______;
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图).则其正极的电极反应为______.
 查看习题详情和答案>>
查看习题详情和答案>>
其化学平衡常数K与温度t的关系如下表,完成下列问题.
| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
(2)判断该反应达到化学平衡状态的依据是______(填序号):
A.2VH2(正)=3VNH3(逆)
B.N2的消耗速率等于H2的消耗速率
C. 溶器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图).则其正极的电极反应为______.
 查看习题详情和答案>>
查看习题详情和答案>>