摘要:有人设计将两根Pt丝作电极插入KOH溶液中.然后向两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式:CH4+2O2+2KOH===K2CO3+3H2O.则关于此燃料电池的下列说法正确的是(一个电子所带电量为1.6×10-19 C) ( ) A.通入甲烷的电极为电池的正极.通入氧气的电极为负极 B.在标准状况下.每消耗5.6 L O2.可向外提供9.6×104 C的电量 C.通入甲烷电极的电极反应为:CH4+10OH― ― 8e-=== CO + 7H2O D.放电一段时间后.溶液pH升高
网址:http://m.1010jiajiao.com/timu3_id_321773[举报]
有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH K2CO3+3H2O,则关于此燃料电池的下列说法错误的是(一个电子所带电量为1.6×10
K2CO3+3H2O,则关于此燃料电池的下列说法错误的是(一个电子所带电量为1.6×10-19C )( )
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗
C.通过甲烷电极的电极反应为:CH4+10OH--8e-![]()
![]() +7H2O
+7H2O
D.放电一段时间后,溶液的pH升高
查看习题详情和答案>>有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式:CH4+2O2+2KOH===K2CO3+3H2O,则关于此燃料电池的下列说法正确的是(一个电子所带电量为1.6×10-19 C) ( )
A、通入甲烷的电极为电池的正极,通入氧气的电极为负极
B、在标准状况下,每消耗5.6 L O2,可向外提供9.6×104 C的电量
C、通入甲烷电极的电极反应为:CH4+10OH― ― 8e-=== CO![]() + 7H2O
+ 7H2O
D、放电一段时间后,溶液pH升高
查看习题详情和答案>>|
有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通过甲烷和氧气而构成燃料电池.该电池中反应的化学方程式为:CH4+2O2+2KOH | |
| [ ] | |
A. |
通过甲烷的电极为电池的负极,通过氧气的电极为正极 |
B. |
在标准状况下,每消耗5.6 L氧气,可向外提供约9.6×104 C的电量 |
C. |
通过甲烷电极的电极反应为:CH4+10OH--8e- |
D. |
放电一段时间后,溶液的pH升高 |
|
有人设计将两根 Pt丝作电极插入KOH溶液中,然后在两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式为CH4+2O2+2KOH | |
| [ ] | |
A. |
通入甲烷的电极为电池的负极,通入氧气的电极为正极 |
B. |
在标准状况下,每消耗 5.6 L O2,可向外提供约9.6×104C的电荷量 |
C. |
通入甲烷一极的电极反应为 CH4+10OH--8e- |
D. |
放电一段时间后,溶液的 pH升高 |
 ,则关于此燃料电池的下列说法错误的是(1个电子所带电量为
,则关于此燃料电池的下列说法错误的是(1个电子所带电量为 )
)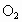 ,可向外提供约
,可向外提供约 的电量
的电量