摘要:如图12所示.为早期制作的发电机及电动机的示意图.A盘和B盘分别是两个可绕固定转轴转动的铜盘.用导线将A盘的中心和B盘的边缘连接起来.用另一根导线将B盘的中心和A盘的边缘连接起来.当A盘在外力作用下转动起来时.B盘也会转动.则下列说法中正确的是 ( ) A.不断转动A盘就可以获得持续的电流.其原因是将整个铜盘看成沿径向排列的无数根铜条.它们做切割磁感线运动.产生感应电动势 B.当A盘转动时.B盘也能转动的原因是电流在磁场 中受到力的作用 C.当A盘顺时针转动时.B盘逆时针转动 D.当A盘顺时针转动时.B盘也顺时针转动
网址:http://m.1010jiajiao.com/timu3_id_320478[举报]
9、磁强计实际上是利用霍尔效应来测量磁感应强度B的仪器。其原理可解释为:如图12所示的一块导体接上a、b、c、d四个电极,将导体放在匀强磁场之中,a、b间通以电流I,c、d间就会出现电势差,只要测出这个电势差U的值,就可测得磁感应强度B。试推导B的表达式。
查看习题详情和答案>> (2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:
(2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图1所示.考虑生产成本和效率,最佳的浸出时间为
12
12
小时,最佳的浸出温度为90
90
℃(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3=Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应为:
MgSO4+2NaF=MgF2↓+Na2SO4;CaSO4+2NaF=CaF2↓+Na2SO4已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过
量NaF溶液反应完全后过滤,则滤液中
| c(Ca2+) |
| c(Mg2+) |
1.5
1.5
.(4)“沉淀”中含杂质离子主要有SO42-、F-、
NH4+
NH4+
和Na+
Na+
;“操作X”包括洗涤
洗涤
和干燥
干燥
.(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图2所示).电池反应为LiCoO2+C6
| 充电 |
| 放电 |
CoO2+Li++e-=LiCoO2
CoO2+Li++e-=LiCoO2
.光气(COCl2)的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H=+108kJ?mol-1.反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14min的COCl2浓度变化未标出):
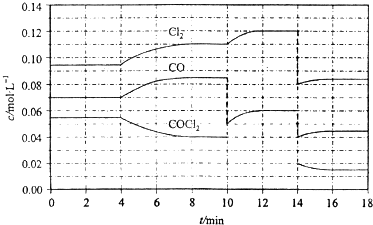
下列说法正确的是( )

下列说法正确的是( )
| A、COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)>v(15~16) | B、第10 min时,改变反应条件,反应重新达到平衡前:v(正)<v(逆) | C、第12 min时,反应重新达到平衡,c(COCl2)≈0.03 mol?L-1 | D、第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |

(1)图1所示一些晶体的结构(晶胞),其中代表干冰的是
B
B
;(2)MgO晶胞空间构型与NaCl晶体相同,MgO晶体中Mg2+的配位数为
6
6
.与同个Mg2+等距且最近的O2-围成的空间几何构型是正八面体
正八面体
.MgO晶体熔点高于NaCl晶体,原因是MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl
MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl
;(3)若C、D代表某种元素中的两种同分异构体,C中原子的杂化类型是
sp3杂化
sp3杂化
,属于原子
原子
晶体.D中原子的杂化类型是sp2杂化
sp2杂化
,D能导电的原因是每个碳原子上未参与杂化的一个2p轨道上电子在层内离域运动(石墨中有自由电子)
每个碳原子上未参与杂化的一个2p轨道上电子在层内离域运动(石墨中有自由电子)
;(4)原子晶体能否形成最密堆积结构?
不能
不能
,原因是共价键有饱和性且配位数远小于12
共价键有饱和性且配位数远小于12
;(5)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如
图2所示,它的化学式是
BaTiO3
BaTiO3
.食盐是日常生活的必需品,也是重要的化工原料.
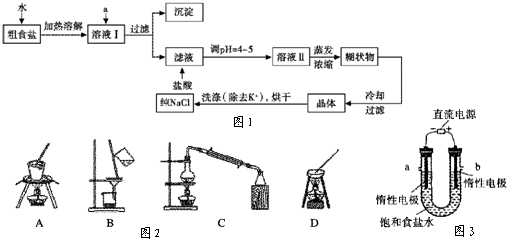
(1)粗食盐常含有少量K+、Ca、Mg2+、SO
等杂质离子,实验室提纯NaCl的流程如图1.
提供的试剂:饱和NaCO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳 冷水
①欲除去溶液Ⅰ中的Ca2+、Mg2-、SO
离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 .
③在整个实验过程中,图2实验装置不可能用到的是 (填序号).
④有关资料
溶液Ⅰ中加入试剂a,只要控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时滤液中Mg2+物质的量浓度将被控制在以下.
(2)电解饱和食盐水的装置如图3所示,若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、“=”或“<”)2L,原因是(用化学方程式解释) .
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为 .装置b 口出来气体的检验方法是 .
查看习题详情和答案>>

(1)粗食盐常含有少量K+、Ca、Mg2+、SO
2- 4 |
提供的试剂:饱和NaCO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳 冷水
①欲除去溶液Ⅰ中的Ca2+、Mg2-、SO
2- 4 |
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
③在整个实验过程中,图2实验装置不可能用到的是
④有关资料
| 化学式 | CaCO3 | CaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 1.0×10-4 | 6.8×10-6 | 1.8×10-11 |
(2)电解饱和食盐水的装置如图3所示,若收集的H2为2L,则同样条件下收集的Cl2
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为