网址:http://m.1010jiajiao.com/timu3_id_320180[举报]
Ⅰ 粗食盐常含有少量K+、Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下

① 欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
____________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为__________________。
③在整个实验过程中,下列实验装置不可能用到的是_____________(填序号)。


Ⅱ 我国化学工程专家侯德榜创立的侯氏制碱法,食盐是其中的主要原料。实验室根据侯氏制碱法并参考下表数据,制备纯碱的主要步骤是:将配置好的NaCl饱和溶液倒入烧杯中加热,控制一定温度范围,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30min,静置、过滤得晶体NaHCO3。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2h,制得Na2CO3固体。

操作过程中反应温度控制在30℃ <t<_______为控制此温度范围,采取的加热方式为________________。
Ⅲ 电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 ________ (填“>”、“=”或 “<”)2L,原因是___________________ 。装置改进后,可用于制备NaOH溶液,若测定溶液中 NaOH的浓度,常用的方法为________________。装置b口出来气体的检验方法:_______________________。

①将盛有4.5g铜屑的蒸发皿置于酒精灯火焰上,灼烧至表面呈现黑色,冷却;
②加16mL3mol?L-1硫酸,再缓慢、分批加入7mL12mol?L-1硝酸(在通风橱进行);
③待反应缓和后,盖上表面皿,用水浴加热至铜屑全溶;
④倾析法趁热将溶液转移到另一蒸发皿中,并在水浴上浓缩到溶液出现晶膜,冷却,过滤;
…
请回答下列问题:
(1)将铜屑灼烧的目的是
(2)加入硝酸时,必须缓慢、分批加入的目的是
(3)控制硝酸总量尽可能小除了环保和节约原料外,还可能的原因是
(4)下图是硫酸铜和硝酸铜的溶解度表(单位:g),请根据表回答:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4?5H2O | 23.1 | 32.0 | 44.6 | 61.8 | 83.8 | 114.0 |
| Cu(NO3)2?xH2O | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
②将五水硫酸铜粗产品提纯,要采取的实验方法是
(5)实验中取用蒸发皿的仪器是
(6)如不用水浴加热蒸发,五水硫酸铜晶体可能会因温度高转变为白色的硫酸铜,此过程属于
四种盐在不同温度下的溶解度(g/100 g水)表
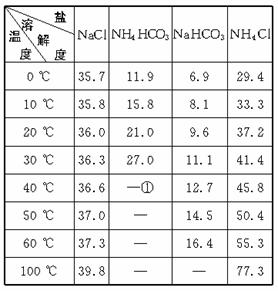
①>35 ℃ NH4HCO3会有分解
请完成下列问题:
(1)反应温度控制在30 ℃—35 ℃,是因为若高于35 ℃,则_______________________,若低于30 ℃,则______________________________________;为控制此温度范围,采取的加热方法为___________________________________。
(2)加料完毕后,继续保温30分钟,目的是________________________________ 。静置后只析出NaHCO3晶体的原因是_____________________________。用蒸馏水洗涤NaHCO3晶体的目的是除去________________________________杂质(以化学式表示)。
(3)过滤所得的母液中含有_______________________(以化学式表示),需加入______________________,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
w(NaHCO3)= __________________。
查看习题详情和答案>>四种盐在不同温度下的溶解度(g/100 g水)表
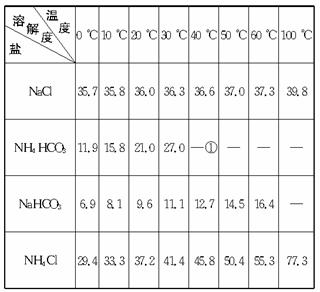
①>35 ℃NH4HCO3会有分解
请完成下列问题:
(1)反应温度控制在30—35 ℃,是因为若高于35 ℃,则_______________,若低于30 ℃,则_______________;为控制此温度范围,采取的加热方法为_______________。
(2)加料完毕后,继续保温30分钟,目的是_______________。静置后只析出NaHCO3晶体的原因是_______________。用蒸馏水洗涤NaHCO3晶体的目的是除去_______________杂质(以化学式表示)。
(3)过滤所得的母液中含有_______________(以化学式表示),需加入_______________,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______________。
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |