网址:http://m.1010jiajiao.com/timu3_id_319713[举报]
2SO2(g)+ O2(g) ![]() 2SO3(g) ;ΔH<0?
2SO3(g) ;ΔH<0?
(1)写出该反应的化学平衡常数表达式K= 。?
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 。(以上均填增大、减小或不变)?
(3)

(4)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达);10 min到15 min的曲线变化的原因可能是? ? (填写编号)。?
A.加了催化剂
B.缩小容器体积?
C.降低温度
D.增加SO3的物质的量
查看习题详情和答案>>2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0?
2SO3(g);ΔH<0?
(1)降低温度,二氧化硫转化率 ,化学反应速率 。(以上均填“增大”“减小”或“不变”)
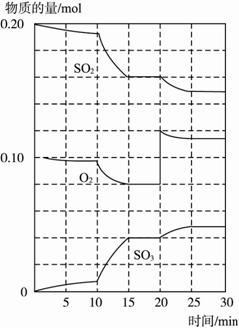
图9-13
(2)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图9-13,反应处于平衡状态的时间是 。?
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是________________________(用文字表达),10 min到15 min的曲线变化的原因可能是(填写编号)。?
a.加了催化剂
b.缩小容器体积?
c.降低温度
d.增加SO3的物质的量
查看习题详情和答案>>在一定条件下,二氧化硫和氧气发生如下反应:?
2SO2(g)+ O2(g) ![]() 2SO3(g);ΔH<0?
2SO3(g);ΔH<0?
(1)写出该反应的化学平衡常数表达式K=______。?
(2)降低温度,该反应K值_______,二氧化硫转化率_______,化学反应速率________。(以上均填增大、减小或不变)?
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是_________。?
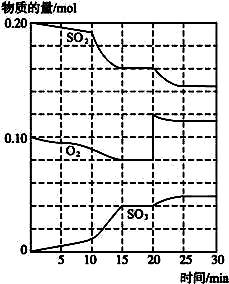
(4)据图判断,反应进行至20min时,曲线发生变化的原因是_________ (用文字表达);10 min到15min的曲线变化的原因可能是_________ (填写编号)。?
A.加了催化剂
B.缩小容器体积?
C.降低温度
D.增加SO3的物质的量
查看习题详情和答案>>在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值_____,二氧化硫转化率____,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(2) 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间有 。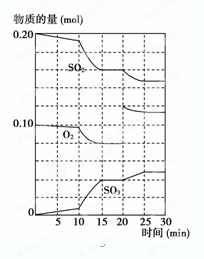
(3) 据上图判断,反应进行至20 min时,曲线发生变化的原因是___________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g) 2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
回答下列问题:
(1)___________________________时段,反应处于平衡状态。
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是_____________;平衡向____________方向移动。(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。,Fe2O3和NiO作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe2O3的 主要优点是_____________。


(4)科研小组在3800C Fe2O3作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b。请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线。 查看习题详情和答案>>