摘要: 在下列各图中.已标出了磁场B的方向.通电直导线中电流I的方向.以及通电直导线所受安培力F的方向.其中符合左手定则的是 慈利一中2010年下学期高二年级第三次月考试卷 物理 时量:60分钟 满分:100分
网址:http://m.1010jiajiao.com/timu3_id_319672[举报]
在下图各物质的相互转化关系中:甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色;G为白色沉淀;H为红褐色沉淀;B溶液焰色反应显黄色.(图中部分反应条件及生成物未全部标出)

填写下列空格:
(1)已知甲原子的质量数为23,则原子核内的中子数为
(2)F的化学式
(3)乙元素原子的结构示意图为
 .
.
(4)写出B与乙反应生成A的离子反应方程式
(5)写出上述反应①的化学反应方程式并标出电子转移的方向与总数
 .
.
查看习题详情和答案>>

填写下列空格:
(1)已知甲原子的质量数为23,则原子核内的中子数为
12
12
.(2)F的化学式
FeCl2
FeCl2
.(3)乙元素原子的结构示意图为


(4)写出B与乙反应生成A的离子反应方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)写出上述反应①的化学反应方程式并标出电子转移的方向与总数


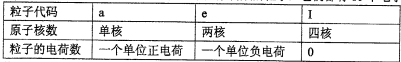
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
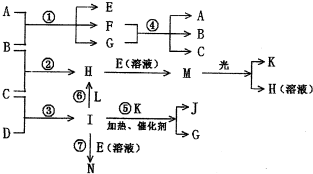
物质A由a、e构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去.
请填写下列空白:
(1)a的结构示意图:
 J分子的极性
J分子的极性
(2)写出下列反应的离子反应方程式:
H+E(溶液)→M
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出该反应的化学方程式
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L的电子式
 ;
;
(5)反应③用于工业生产时应在
所使用的一种特殊材料的名称为
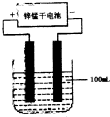
(6)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生 112ml(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=
查看习题详情和答案>>

物质A由a、e构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去.
请填写下列空白:

(1)a的结构示意图:


极性分子
极性分子
,在F的晶体中,与a离子距离最近且相等的a离子个数为12
12
个.(2)写出下列反应的离子反应方程式:
H+E(溶液)→M
H++ClO-═HClO
H++ClO-═HClO
,F+G→A+B+C2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
.
| ||
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出该反应的化学方程式
NaClO+2NH3═N2H4+NaCl+H2O
NaClO+2NH3═N2H4+NaCl+H2O
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L的电子式


(5)反应③用于工业生产时应在
合成塔
合成塔
中进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为
离子交换膜
离子交换膜
,在该工业生产中它还具有的作用是只允许阴离子和气体通过从而防止NaOH与氯气反应
只允许阴离子和气体通过从而防止NaOH与氯气反应
.(6)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生 112ml(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=
13
13
.(假设气体完全逸出,溶液体积不变),此时锌锰干电池中消耗锌0.325
0.325
克.
随着化石能源的减少,新能源的开发利用日益迫切.
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ?mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ?mol-1
2HI(g)=H2(g)+I2(g)△H=c kJ?mol-1
则:2H2O(g)=2H2(g)+O2(g)△H= kJ?mol-1
(2)甲醇制氢有以下三个反应:
CH3OH(g)=CO(g)+2H2(g)△H=+90.8kJ?mol-1 Ⅰ
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-43.5kJ?mol-1 Ⅱ
CH3OH(g)+
O2(g)=CO2(g)+2H2(g)△H=-192.0kJ?mol-1 Ⅲ
①当CH3OH(g)、O2(g)、H2O(g)总进料量为1mol时,且n(CH3OH):n(H2O):n(O2)=0.57:0.28:0.15,在0.1MPa、473~673K温度范围内,各组分的平衡组成随温度变化的关系曲线见图.(图中Yi表示各气体的体积分数,氧气的平衡浓度接近0,图中未标出).下列说法正确的是 .
A.在0.1MPa、473~673K温度范围内,甲醇有很高的转化率
B.温度升高有利于氢气的制备
C.寻找在较低温度下的催化剂在本制氢工艺中至关重要
②已知反应Ⅱ在T1℃时K=1,向恒容的密闭容器中同时充入1.0mol CO、3.0molH2O,达到平衡时CO的转化率为 .在反应达到平衡后再向其中加入1.0mol CO、1.0mol H2O、1.0mol CO2和1.0mol H2,此时该反应的v正 v逆(填“>”、“<”或“=”).
(3)一种以甲醇作燃料的电池示意图见图.写出该电池放电时负极的电极反应式: .
(4)LiBH4有很高的燃烧热,可做火箭的燃料,写出其燃烧反应的化学方程式: .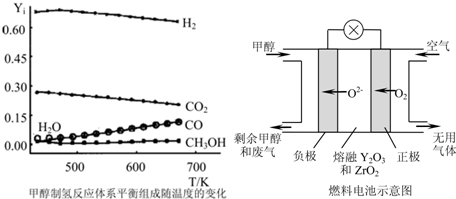
查看习题详情和答案>>
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ?mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ?mol-1
2HI(g)=H2(g)+I2(g)△H=c kJ?mol-1
则:2H2O(g)=2H2(g)+O2(g)△H=
(2)甲醇制氢有以下三个反应:
CH3OH(g)=CO(g)+2H2(g)△H=+90.8kJ?mol-1 Ⅰ
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-43.5kJ?mol-1 Ⅱ
CH3OH(g)+
| 1 | 2 |
①当CH3OH(g)、O2(g)、H2O(g)总进料量为1mol时,且n(CH3OH):n(H2O):n(O2)=0.57:0.28:0.15,在0.1MPa、473~673K温度范围内,各组分的平衡组成随温度变化的关系曲线见图.(图中Yi表示各气体的体积分数,氧气的平衡浓度接近0,图中未标出).下列说法正确的是
A.在0.1MPa、473~673K温度范围内,甲醇有很高的转化率
B.温度升高有利于氢气的制备
C.寻找在较低温度下的催化剂在本制氢工艺中至关重要
②已知反应Ⅱ在T1℃时K=1,向恒容的密闭容器中同时充入1.0mol CO、3.0molH2O,达到平衡时CO的转化率为
(3)一种以甲醇作燃料的电池示意图见图.写出该电池放电时负极的电极反应式:
(4)LiBH4有很高的燃烧热,可做火箭的燃料,写出其燃烧反应的化学方程式:

已知a、e、I为三种由短周期元素构成的10个电子的粒子,其结构特点如下:
物质A由a、e 构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去.请填写下列空白:

(1)写出下列物质的化学式:B
(2)写出下列反应的离子反应方程式:H+E(溶液)→M
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式
 ;
;
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L 的电子式
的电子式
 ;
;
(5)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=
查看习题详情和答案>>
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |

(1)写出下列物质的化学式:B
Cl2
Cl2
,JNO
NO
.(2)写出下列反应的离子反应方程式:H+E(溶液)→M
H++ClO-═HClO
H++ClO-═HClO
,F+G→A+B+C2Cl-+2H2O
Cl2+H2+2OH-
| ||
2Cl-+2H2O
Cl2+H2+2OH-
;
| ||
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式


(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L
 的电子式
的电子式

(5)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=
13
13
.(假设气体完全逸出,溶液体积不变)已知,卤代烃中的卤族元素在强碱溶液中可以被羟基取代;有机物A-H能发生如图所示一系列变化,其中C能发生银镜反应.

按下列各要求填写
(1)写出结构简式:A
 .
.
(2)写出所标反应的化学方程式:①
(3)写出下列序号发生的化学反应类型:②
(4)C、G、H中与等物质的量的乙炔燃烧消耗的氧气相同的化合物是(填字母)
查看习题详情和答案>>

按下列各要求填写
(1)写出结构简式:A
CH2=CHCl
CH2=CHCl
,B

(2)写出所标反应的化学方程式:①
CH≡CH+H2O
CH3CHO
| 催化剂 |
| 加热、加压 |
CH≡CH+H2O
CH3CHO
.④| 催化剂 |
| 加热、加压 |
2CH3COOH+HOCH2CH2OH
CH3COOCH2CH2OOCCH3+2H2O
| 催化剂 |
| 加热 |
2CH3COOH+HOCH2CH2OH
CH3COOCH2CH2OOCCH3+2H2O
.| 催化剂 |
| 加热 |
(3)写出下列序号发生的化学反应类型:②
加成
加成
③取代(水解)
取代(水解)
.(4)C、G、H中与等物质的量的乙炔燃烧消耗的氧气相同的化合物是(填字母)
C、G
C、G
.