网址:http://m.1010jiajiao.com/timu3_id_315100[举报]
(1小题1分,2、3小题各2分,共5分)用15.8g KMnO4与12mol/L的 浓HCl发生。反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O 通过计算解答以下问题:
(1)KMnO4能使多少毫升浓HCl发生上述反应?
(2)被氧化的HCl的物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?电子转移总数为多少?
查看习题详情和答案>>
(1小题1分,2、3小题各2分,共5分)用15.8 g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O 通过计算解答以下问题:
g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O 通过计算解答以下问题:
(1)KMnO4能使多少毫升浓HCl发生上述反应?
(2)被氧化的HCl的物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?电子转移总数为多少?
(1小题1分,2、3小题各2分,共5分)用15.8gKMnO4与12mol/L的 浓HCl发生。反应方程式如下:2KMnO4 + 16HCl =2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O 通过计算解答以下问题:
(1)KMnO4能使多少毫升浓HCl发生上述反应?
(2)被氧化的HCl的物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?电子转移总数为多少?
查看习题详情和答案>>
(本题共2小题,22分)
Ⅰ.几种短周期元素的原子半径及某些化合价见下表:
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
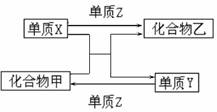
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表各组物质之间通过一步反应不能实现如图所示转化的是 ( )
|
选项 |
X |
Y |
Z |
甲 |
|
|
A |
H2 |
Si |
Cl2 |
SiCl4 |
HCl |
|
B |
Mg |
C |
O2 |
CO2 |
MgO |
|
C |
Zn |
Fe |
Cl2 |
FeCl2 |
ZnCl2 |
|
D |
O2 |
N2 |
H2 |
NH3 |
H2O |
不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。
查看习题详情和答案>>
 乙
乙