网址:http://m.1010jiajiao.com/timu3_id_314488[举报]
反应中CO2的浓度随时间变化情况如下图:
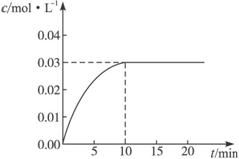
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为___________;反应达平衡时,c(H2)=______________。
(2)判断该反应达到平衡的依据是_________。
①CO减少的化学反应速率和CO2减少的化学反应速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_________。
查看习题详情和答案>>在某一容积为5 L的密闭容器内,加入0.2 mol CO和0.2 mol H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图所示:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图所示:
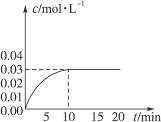
(1)根据图中数据,反应开始至达到平衡时,CO的化学反应速率为__________,反应达平衡时,c(H2)=__________。
(2)判断该反应达平衡的依据是__________(填序号)。
①CO减少的速率和CO2减少的速率相等
② CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④该条件下正、逆反应速率都为零
(3)如果一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同条件下,反应达平衡时,c(H2O)=__________。
查看习题详情和答案>>在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示: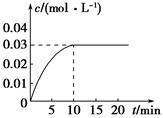
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
①CO减小的化学反应速率和CO2减小的化学反应速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④正、逆反应速率都为零
 CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
①CO减小的化学反应速率和CO2减小的化学反应速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④正、逆反应速率都为零
![]() 在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0。
在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0。
反应中CO2的浓度随时间变化情况如下图:
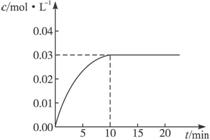
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为___________;反应达平衡时,c(H2)=______________。
(2)判断该反应达到平衡的依据是_________。
①CO减少的化学反应速率和CO2减少的化学反应速率相等
②CO、H2O、CO2、H2的浓度都相等k+s-5#u ![]()
③CO、H2O、CO2、H2的浓度都不再发生变化
④正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_________。
查看习题详情和答案>>