摘要:9.对于可逆反应:2SO2(g)+O2(g)2SO3(g).在体积固定的密闭容器中反应.下列能够说明该反应达到化学平衡状态的标志是 ( ) A.单位时间内生成n molO2的同时.生成2n mol SO3 B.用SO2.O2.SO3表示的反应速率之比为2∶1∶2的状态 C.混合气体的质量不再变化的状态 D.混合气体的密度不再变化的状态
网址:http://m.1010jiajiao.com/timu3_id_314146[举报]
对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),在体积固定的密闭容器中反应,下列能够说明该反应达到化学平衡状态的标志是 ( )
2SO3(g),在体积固定的密闭容器中反应,下列能够说明该反应达到化学平衡状态的标志是 ( )
A.单位时间内生成n molO2的同时,生成2n mol SO3
B.用SO2、O2、SO3表示的反应速率之比为2∶1∶2的状态
C.混合气体的质量不再变化的状态
D.混合气体的密度不再变化的状态
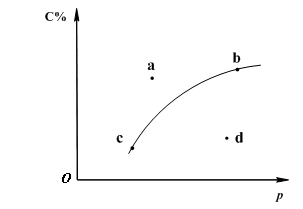
查看习题详情和答案>>对于可逆反应2A(?)+B(g)![]() 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是 (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是 ;
(3)在a、b、c三种条件下达平衡时,v(a)、v(b)、v(c)按由大到小排序___________;
 |
|
(4)对于2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率 (填“会”或“不会”)。
查看习题详情和答案>>
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)△H<0
(1)该反应450℃时的平衡常数______500℃时的平衡常数(填“大于”、“小于”或“等于”).
(2)该化学达到平衡的标志是______.
a.v(O2)正=2v( SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
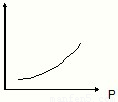
(3)恒温、密闭容器体系中充入一定量SO2、O2,反应达平衡时,某物理量随体系总压强(p)的关系如图所示所示.该物理量可能是______.
a.平衡体系中SO2的体积分数
b.气体的平均相对分子质量
c.混合气体的密度
d.平衡体系中SO2的转化率
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=______ mol?L-1?min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol.
(5)压强及温度对SO2转化率的影响如表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
利用表中数据分析.在实际生产中选择的适宜生产条件是:温度______℃,压强______MPa.
 查看习题详情和答案>>
查看习题详情和答案>>
2SO2(g)+O2(g)?2SO3(g)△H<0
(1)该反应450℃时的平衡常数______500℃时的平衡常数(填“大于”、“小于”或“等于”).
(2)该化学达到平衡的标志是______.
a.v(O2)正=2v( SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)恒温、密闭容器体系中充入一定量SO2、O2,反应达平衡时,某物理量随体系总压强(p)的关系如图所示所示.该物理量可能是______.
a.平衡体系中SO2的体积分数
b.气体的平均相对分子质量
c.混合气体的密度
d.平衡体系中SO2的转化率
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=______ mol?L-1?min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol.
(5)压强及温度对SO2转化率的影响如表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
 查看习题详情和答案>>
查看习题详情和答案>>
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为
(2)已知某温度下,反应2SO2(g)+O2 (g)?2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol?L-1,C(O2)=1mol?L-1,当反应在该温度下SO2转化率为80%时,该反应
(3)对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=a kJ?mol-1;若a+b>c+d,增大压强平衡向
查看习题详情和答案>>
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为
=
| c2(CO) |
| c(CO2) |
=
;已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为| c2(CO) |
| c(CO2) |
K=K1×K2
K=K1×K2
.(2)已知某温度下,反应2SO2(g)+O2 (g)?2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol?L-1,C(O2)=1mol?L-1,当反应在该温度下SO2转化率为80%时,该反应
否
否
(填“是”或“否”)达到化学平衡状态,若未达到,向逆反应
逆反应
(填“正反应”或“逆反应”) 方向进行.(3)对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=a kJ?mol-1;若a+b>c+d,增大压强平衡向
正反应
正反应
(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a<
<
0(填“>”或“<”)化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为______;已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为______.
(2)已知某温度下,反应2SO2(g)+O2 (g)?2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol?L-1,C(O2)=1mol?L-1,当反应在该温度下SO2转化率为80%时,该反应______(填“是”或“否”)达到化学平衡状态,若未达到,向______(填“正反应”或“逆反应”) 方向进行.
(3)对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=a kJ?mol-1;若a+b>c+d,增大压强平衡向______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a______0(填“>”或“<”)
查看习题详情和答案>>
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为______;已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为______.
(2)已知某温度下,反应2SO2(g)+O2 (g)?2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol?L-1,C(O2)=1mol?L-1,当反应在该温度下SO2转化率为80%时,该反应______(填“是”或“否”)达到化学平衡状态,若未达到,向______(填“正反应”或“逆反应”) 方向进行.
(3)对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=a kJ?mol-1;若a+b>c+d,增大压强平衡向______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a______0(填“>”或“<”)