摘要:反应NO+O2 +NO2+ H2O-HN03是多组化学计量数的化学方程式.当氧气有 1/2 被 NO 还原时.此反应各物质化学计量数之比为( ) A. 4:9:14:28 B.2:3:6:4:8 C. 8:9:12:10:20 D. 任意比均可
网址:http://m.1010jiajiao.com/timu3_id_313876[举报]
将4mol SO3气体和4mol NO置于2L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g)?2SO2+O2;2NO+O2?2NO2.
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1mol、n(NO2)=3.6mol,则此时SO3气体的物质的量为
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和
(3)若在另外一个2L的容器中只发生反应2NO+O2?2NO2,其中NO、O2、NO2的起始浓度依次是0.2mol?L-1、0.2mol?L-1,当反应达到平衡时,各物质的浓度可能是
A、c(NO)=0.35mol?L-1或c(NO)=0.09mol?L-1B、c(NO2)=0.4mol?L-1
C、c(NO2)=0.35mol?L-1D、c(O2)=0.2mol?L-1或c(NO)=0.4mol?L-1.
查看习题详情和答案>>
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1mol、n(NO2)=3.6mol,则此时SO3气体的物质的量为
0.2
0.2
mol.(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和
SO2
SO2
,或NO和NO2
NO2
(填分子式).(3)若在另外一个2L的容器中只发生反应2NO+O2?2NO2,其中NO、O2、NO2的起始浓度依次是0.2mol?L-1、0.2mol?L-1,当反应达到平衡时,各物质的浓度可能是
A、C
A、C
(选填字母代号).A、c(NO)=0.35mol?L-1或c(NO)=0.09mol?L-1B、c(NO2)=0.4mol?L-1
C、c(NO2)=0.35mol?L-1D、c(O2)=0.2mol?L-1或c(NO)=0.4mol?L-1.
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( )
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( )“神七”登天谱写了我国航天事业的新篇章.火箭升空需要高能燃料,经常是用肼(N2H4)作为燃料,N2O4做氧化剂.
(1)已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1
请写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为
(3)一定条件下,在2L密闭容器中起始时投入2mol NH3和4mol O2,发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,测得平衡时的数据如下表:
①在T1时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=
②T1和T2的大小关系是T1
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为
有人提出,可以设计反应2CO═2C+O2(△H>0)来消除CO的污染,请你判断该反应是否能自发进行并说明理由?答:
(5)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液.
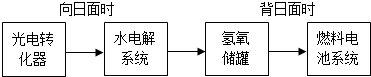
如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为
查看习题详情和答案>>
(1)已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1
请写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 083.0 kJ?mol-1
2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 083.0 kJ?mol-1
.(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为
NaClO+2NH3═N2H4+NaCl+H2O
NaClO+2NH3═N2H4+NaCl+H2O
.(3)一定条件下,在2L密闭容器中起始时投入2mol NH3和4mol O2,发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,测得平衡时的数据如下表:
| 有关物质的物质的量/mol | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
0.08 mol?L-1?min-1
0.08 mol?L-1?min-1
.②T1和T2的大小关系是T1
<
<
T2(填“>”“<”或“=”).(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为
2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O═CO+2OH-)
2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O═CO+2OH-)
.有人提出,可以设计反应2CO═2C+O2(△H>0)来消除CO的污染,请你判断该反应是否能自发进行并说明理由?答:
不能,因为该反应的△S<0
不能,因为该反应的△S<0
.(5)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液.

如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为
2
2
mol.(2011?湖北模拟)在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应2NO+O2?2NO2,n(NO)随时间的变化如下表:
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为
(2)若升温到850℃,平衡后n(NO)=n(NO2),则该反应是
(3)下列能说明该反应已达到平衡的是
A.容器内压强不变 B.容器内气体密度不变
C.n(NO)=n(NO2) D.容器内气体颜色不变
E.容器内混合气体的平均分子量不变 F.v(NO2)=2v(O2)
(4)若改变某一条件,达新平衡时n(NO)=0.06mol,下列说法正确的是
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.NO的转化率一定增大
D.可能是缩小了容器的体积
(5)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式
查看习题详情和答案>>
| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)用O2表示从0~20s内该反应的速率为
0.0015mol/(L.S)
0.0015mol/(L.S)
;达到平衡时NO的转化率为65%
65%
.(2)若升温到850℃,平衡后n(NO)=n(NO2),则该反应是
放
放
热反应(填:“吸”、“放”)(3)下列能说明该反应已达到平衡的是
AED
AED
.A.容器内压强不变 B.容器内气体密度不变
C.n(NO)=n(NO2) D.容器内气体颜色不变
E.容器内混合气体的平均分子量不变 F.v(NO2)=2v(O2)
(4)若改变某一条件,达新平衡时n(NO)=0.06mol,下列说法正确的是
CD
CD
.A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.NO的转化率一定增大
D.可能是缩小了容器的体积
(5)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式
2NO(g)+O2(g) 2NO2(g);△H=-12.5aKJ?mol-1
2NO2(g);△H=-12.5aKJ?mol-1
 2NO2(g);△H=-12.5aKJ?mol-1
2NO2(g);△H=-12.5aKJ?mol-12NO(g)+O2(g) 2NO2(g);△H=-12.5aKJ?mol-1
2NO2(g);△H=-12.5aKJ?mol-1
. 2NO2(g);△H=-12.5aKJ?mol-1
2NO2(g);△H=-12.5aKJ?mol-1