摘要:反应CO(g)+H2O(g) CO2(g)+H2(g) .在800℃时达到平衡.分别改变下列条件.化学平衡状态发生改变的是( ) A.将压强减小至原来的一半 B.将反应温度升高至1000℃ C.添加催化剂 D.增大水蒸气的浓度
网址:http://m.1010jiajiao.com/timu3_id_313299[举报]
反应CO(g)+H2O(g)?CO2(g)+H2(g)在800℃达到平衡时,分别改变下列条件,K值会发生变化的是( )
查看习题详情和答案>>
| A.将体积减小至原来的一半 |
| B.加入催化剂 |
| C.将反应温度升高至1000℃ |
| D.增大水蒸气的浓度 |
800℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应
CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=
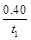 mol/(L·min)
mol/(L·min)B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 查看习题详情和答案>>