摘要:密闭体系中发生下列反应:N2 + 3H2 ==== 2NH3. 如图是某一时间段反应速率与反应进程的曲线关系图. 回答下列问题: v (1)处于平衡状态的时间段是 v(逆) v(逆) (2)t1.t3.t4时刻.体系中分别是什么条件发生了变化? V(正) t1: t3: t4: V(正) (3)下列时间段中.氨的百分含量最高的是 t 0 t1 t2 t3 t4 t5 t6 A.t 0~t1. B.t2~t3 C.t3~t4 D.t5~t6
网址:http://m.1010jiajiao.com/timu3_id_312021[举报]
(6分)密闭体系中发生下列反应:N2 + 3H2 ="===" 2NH3(正反应为放热反应),如图是某一时间段反应速率与反应进程的曲线关系图。
回答下列问题:
(1)处于平衡状态的时间段是_________________________________________________________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1:_______ t3:_______ t4:_________
(3)下列时间段中,氨的百分含量最高的是________
| A.t 0~t1、 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
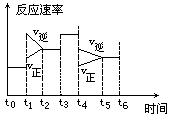
密闭体系中发生下列反应:N2 + 3H2 ==== 2NH3(正反应为放热反应),如图是某一时间段反应速率与反应进程的曲线关系图。
回答下列问题:
(1)处于平衡状态的时间段是_________________________________________________________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1:_______ t3:_______ t4:_________
(3)下列时间段中,氨的百分含量最高的是________
A、t 0~t1、 B、t2~t3 C、t3~t4 D、t5~t6
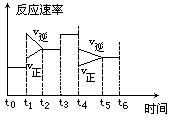
查看习题详情和答案>>(6分)密闭体系中发生下列反应:N2 + 3H2 ="===" 2NH3(正反应为放热反应),如图是某一时间段反应速率与反应进程的曲线关系图。
回答下列问题:
(1)处于平衡状态的时间段是_________________________________________________________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1:_______ t3:_______ t4:_________
(3)下列时间段中,氨的百分含量最高的是________

回答下列问题:
(1)处于平衡状态的时间段是_________________________________________________________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1:_______ t3:_______ t4:_________
(3)下列时间段中,氨的百分含量最高的是________
| A.t 0~t1、 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
一密闭容器中发生下列反应:N2(g)+3H2(g) 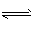 2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:
2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:
 2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:
2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题: 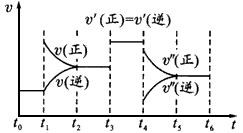
(1)处于平衡状态的时间段是________。
(2)t1、t3、t4时刻,体系中分别是什么条件?t1______,t3_______,t4______。
(3)下列时间段中,氨的体积分数最高的是___________。
A.t2~t3
B.t3~t4
C.t4~t5
D.t5~t6
查看习题详情和答案>>
(2)t1、t3、t4时刻,体系中分别是什么条件?t1______,t3_______,t4______。
(3)下列时间段中,氨的体积分数最高的是___________。
A.t2~t3
B.t3~t4
C.t4~t5
D.t5~t6
可逆反应N2+3H2?2NH3是工业上合成氨的重要反应.
(1)根据图1请写出合成氨的热化学方程式
(2)图1中虚线部分是通过改变化学反应条件是
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率随时间的关系,其中表示平衡混合物中NH3的含量最高的时间段是
(4)在一定温度压强下,下列各项能作为判断该反应达到化学平衡状态的依据是
a.单位时间内生成2n molNH3的同时生成n molN2 b.容器内压强不再改变
c.容器内N2、H2、NH3的浓度之比为1:3:2 d.混合气体的密度不再改变
e.混合气体的平均相对分子质量不再改变 f.2v正(H2)=3v正(NH3)
(5)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为
.若此时再向该容器中投入a mol H2、amol N2和amol NH3,则此时化学平衡
查看习题详情和答案>>

(1)根据图1请写出合成氨的热化学方程式
N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kg/mol
N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kg/mol
(热量用E1、E2或E3表示)(2)图1中虚线部分是通过改变化学反应条件是
使用催化剂
使用催化剂
,请解释原因因为催化剂能改变反应的路径,使发生反应所需的活化能降低
因为催化剂能改变反应的路径,使发生反应所需的活化能降低
.(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率随时间的关系,其中表示平衡混合物中NH3的含量最高的时间段是
t0-t1
t0-t1
(用含t符号表示)(4)在一定温度压强下,下列各项能作为判断该反应达到化学平衡状态的依据是
ade
ade
(填字母).a.单位时间内生成2n molNH3的同时生成n molN2 b.容器内压强不再改变
c.容器内N2、H2、NH3的浓度之比为1:3:2 d.混合气体的密度不再改变
e.混合气体的平均相对分子质量不再改变 f.2v正(H2)=3v正(NH3)
(5)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为
| 16 |
| a2 |
| 16 |
| a2 |
正向
正向
移动(填“正向”、“逆向”或“不”)