摘要:21. 中混有的少量NaHCO3.用 .化学方程式为: (2)除去NaOH固体中混有的少量Na2O2.用 .离子方程式为 中混有的少量KI.用 .离子方程式为
网址:http://m.1010jiajiao.com/timu3_id_310945[举报]
回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如图所示.
根据上图所示步骤并参考表格数据,回答下列问题.
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式: .
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是 .

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是 .
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是 .
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为 .
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为 .
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 .
查看习题详情和答案>>

根据上图所示步骤并参考表格数据,回答下列问题.
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为
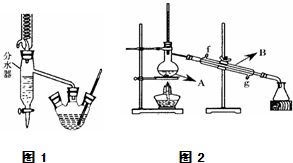 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
I乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,请写出其中一种的结构简式
CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3
CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3
.(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是
乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低;
乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低;
.Ⅱ乙酸正丁酯粗产品的制备
(1)将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步操作的目的是
溶解正丁醇;中和乙酸;降低乙酸正丁酯的溶解度,便于分层析出;
溶解正丁醇;中和乙酸;降低乙酸正丁酯的溶解度,便于分层析出;
.(2)将酯层采用如图1所示装置蒸馏.
①图2中仪器A、B的名称分别为
蒸馏烧瓶、冷凝管
蒸馏烧瓶、冷凝管
.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
126.1℃
126.1℃
左右.Ⅲ计算产率
称量制得的乙酸正丁酯的质量为13.92g,则乙酸正丁酯的产率为
60%
60%
.(2013?上海二模)碳酸钠俗称纯碱,其用途很广.实验室中,用碳酸氢铵和饱和食盐水可制得纯碱.各物质在不同温度下的溶解度见表.
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7.
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置,
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱.
(1)“化盐与精制”可除去的粗盐中的杂质离子是
(2)“转化”的离子方程式是
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是
(4)a,b处的操作分别是
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL.此时发生的反应为:CO32-+H+→HCO3-
①样品中碳酸钠质量百分含量的表达式是
×100%
×100%.
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL.滴定终点时溶液颜色的变化是
查看习题详情和答案>>
| 温度℃ 溶解度 溶质 g/100g水 |
10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7.
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置,
a
a
、b
b
;③得到NaHCO3晶体.Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱.
(1)“化盐与精制”可除去的粗盐中的杂质离子是
Ca2+、Mg2+
Ca2+、Mg2+
.(2)“转化”的离子方程式是
Na++HCO3-=NaHCO3↓
Na++HCO3-=NaHCO3↓
.(3)“转化”过程中,温度控制在30~35℃之间的加热方式是
水浴加热
水浴加热
;为什么温度控制在30~35℃之间?温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小
温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小
.(4)a,b处的操作分别是
过滤
过滤
、洗涤
洗涤
.(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL.此时发生的反应为:CO32-+H+→HCO3-
①样品中碳酸钠质量百分含量的表达式是
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL.滴定终点时溶液颜色的变化是
黄色变为橙色且半分钟不变
黄色变为橙色且半分钟不变
;根据实验数据,如何判断样品含有NaHCO3V2>V1则含有NaHCO3
V2>V1则含有NaHCO3
.过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域.下图是以大理石(主要杂质Fe2O3)等为原料制取CaO2的流程:
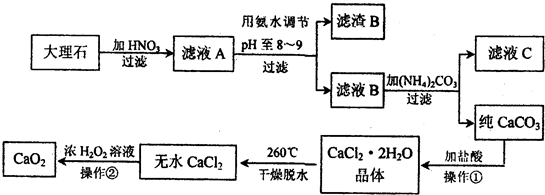
(1)操作①中应包括
A溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
请写CaCO3 和稀盐酸反应的离子方程式:
(2)用氨水调节pH至8-9的目的:
(3)从滤液C中可回收得到的工业产品的化学式为
(4)操作②的化学反应方程式:
查看习题详情和答案>>

(1)操作①中应包括
A、B、E
A、B、E
(填序号).A溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
请写CaCO3 和稀盐酸反应的离子方程式:
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
.(2)用氨水调节pH至8-9的目的:
除去Fe3+ (或使Fe3+转化为Fe(OH)3沉淀被除去)
除去Fe3+ (或使Fe3+转化为Fe(OH)3沉淀被除去)
.(3)从滤液C中可回收得到的工业产品的化学式为
NH4NO3
NH4NO3
.(4)操作②的化学反应方程式:
CaCl2+H2O2=CaO2↓+2HCl
CaCl2+H2O2=CaO2↓+2HCl
.过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面.如图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程.

请回答下列问题:
(1)操作①应包括下列操作中的
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
查看习题详情和答案>>

请回答下列问题:
(1)操作①应包括下列操作中的
ABE
ABE
(填序号).A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是
除去Fe3+
除去Fe3+
.(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+
是
是
(填“是”或“否”)沉淀完全.[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9](4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+)
<
<
c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
CaCl2+H2O2 CaO2+2HCl
CaO2+2HCl
 CaO2+2HCl
CaO2+2HClCaCl2+H2O2 CaO2+2HCl
CaO2+2HCl
.一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀.用简要的文字解释需用氢氧化钠调节pH至9~11的原因 CaO2+2HCl
CaO2+2HCl入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成
入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成
.